Buch der Synergie

| Blättern |
 TEIL C
TEIL C
MICRO ENERGY HARVESTING
MuskulÄre
Systeme (I)
Muskelenergetische Systeme der makroskopischen Ebene sind
bereits ausführlich im vorangegangenen Kapitel Muskelkraft beschrieben
worden. Hier geht es dem gegenüber um einzelne Muskelzellen oder
kleinere Stränge, die nichts desto trotz ebenfalls dazu angehalten
werden, energetische Arbeit zu leisten.
(Grafik)
Die erste Meldung, die mir diesbezüglich vorliegt, stammt aus dem
Jahr 1999, als die beiden Bioingenieure Robert
Glenn Dennis und Hugh M. Herr am Artificial
Intelligence Laboratory des Massachusetts Institute of Technology (MIT)
die Biomechatronics Group gründen, um muskel-basierte Roboterantriebe
und Hybridprothesen zu entwickeln. Herr ist dazu auch persönlich motiviert,
da ihn eine Erfrierung beide Beine unterhalb des Knies gekostet hat
und er nun hofft, mit dieser Arbeit zur Verbesserung künstlicher
Gliedmaße beizutragen.
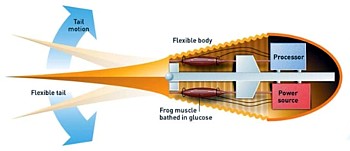
Im September 2000 präsentieren die beiden Forscher ihr erstes funktionierende Gerät, das sie herstellen, indem sie in einen 12 cm langen Roboter-Fisch ein Paar Halbsehnenmuskeln eines Frosches einnähen. Ein Mikroprozessor sendet den Muskeln auf beiden Seiten des Hybriden elektrische Signale, worauf sich diese zusammenziehen und den Prototyp in einer Glukoselösung herumschwimmen lassen, welche die Muskeln wiederum mit Energie versorgt. Allerdings ,halten’ die Muskeln dabei nur für sieben Stunden.
Damit sich der Prototyp, der eine Höchstgeschwindigkeit von etwa 60 mm/s erreicht, auch in normalem Wasser bewegen kann, soll er in einem nächsten Schritt mit einem kleinen Magen ausgestattet werden, der die Muskeln über ein System feiner Kanäle mit Glukose versorgt. Für größere Muskeln müßte zudem ein Kreislauf-System hinzugefügt werden, das die Glukose in die Muskeln pumpt.

Das langfristige Ziel ist, eines Tages Prothesen mit natürlichem Gewebe verbinden zu können – doch auch die US-Army will davon profitieren, weshalb die DARPA das Projekt finanziert und darauf hofft, daß Soldaten künftig mit muskelbetriebenen Anzügen schneller laufen, höher springen und mehr Waffen tragen können (als ob es nichts sinnvolles mit der Technologie anzustellen gäbe...). Es ist fast nicht zu glauben, aber das Pentagon investiert 50 Mio. $ in die Entwicklung dieser Muskel-Anzüge, in denen lebende Muskeln die Roboterkomponenten aktivieren sollen.
Dennis arbeitet zudem gemeinsam mit seinem Kollegen Paul Kosnik von der University of Michigan daran, Muskel-Kulturen zu kultivieren, die für mehrere Monate leben. Dabei setzen die Wissenschaftler menschliche Muskelfasern ein, die sie im Labor wachsen lassen, indem sie diese elektrisch stimulieren. Es soll das erste Mal sein, daß menschliche Muskeln künstlich gezüchtet werden. Ausgangspunkt ist die Überlegung, daß die Technik in Zukunft einige Tierversuche überflüssig machen könnte, wenn sich Chemikalien auch an Muskelkulturen testen ließen.
Obwohl die Muskeln bereits drei bis fünf Monate überleben, verglichen mit nur ein paar Stunden bei natürlichen, aus dem Körper entfernten Muskeln, sind sie nur ein Zehntel so stark wie ihre originalen Vorbilder. Zudem sollen sie leicht oxidieren. Sogar der MIT-Kollege Hugh Herr ist skeptisch und fragt sich, wozu man künstliche Muskeln aufbaut, wenn sich echte Muskeln doch der Umwelt anpassen lassen und zudem in der Lage sind, sich selbst zu heilen und auch selbst zu regulieren. Jedenfalls lassen sich Kosnik und Dennis ihre Technologie patentieren (US-Nr. 6.114.164, angemeldet 1998, erteilt 2000).
Ein ausführlicher Bericht über den schwimmenden Muskel-Roboter von Herr und Dennis, der inzwischen an der University of North Carolina tätig ist, erscheint im Oktober 2004. Hier wird spezifiziert, daß der Roboter für insgesamt vier Stunden geschwommen ist und eine Lebensdauer von 42 Stunden hatte, bevor seine Geschwindigkeit auf unter 75 % des o.g. Maximums fiel.
In den späten 1990er Jahren beschäftigen sich die
Professoren Carlo D. Montemagno und G. D.
Bachand an der Cornell University in New
York mit der Konstruktion organisch/anorganischer nanomechanischer
Geräte, die durch biomolekulare Drehmotoren aus genetisch
veränderten Proteinen angetrieben werden. Die Ziele des Teams sind,
ein System zur Herstellung rekombinierter biomolekularer Motoren zu
schaffen, biologische Molekülen auf Nanofabrikations-Substraten genau
zu positionieren und zu orientieren, sowie die Leistungsdaten biomolekularer
Motoren in einem Hybridsystem zu erfassen.
In einem Bericht vom November 2000 beschreiben die Wissenschaftler, wie sie den ersten biomolekularen Motor aus dem Enzym ATPase konstruieren und testen, der mit einem winzigen Propeller bestückt ist. Das zytoplasmatische F1 Fragment der ATPase funktioniert dabei als ATP-betriebener Rotationsmotor und soll als mechanischer Aktuator zukünftig in selbstorganisierte nanomechanische Systeme integriert werden.
Das ATP (Adenosintriphosphat) ist ein Endprodukt von Prozessen wie Photosynthese und Zellatmung und kommt in allen lebenden Zellen vor. Es spielt eine wichtige Rolle beim intrazellulären Energiestoffwechsel als temporärer Speicher von chemischer Energie und liefert diese für die mechanische Arbeit lebender Systeme, wie beispielsweise die Zellteilung und die Muskelkontraktion.
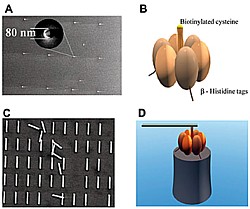
Die Propeller aus Nickel sind jeweils lediglich 750 nm lang und 150 nm im Durchmesser und liegen damit im Größenbereich von Viren (17 – 1.000 nm). Dünne Schichten aus verbindenden Chemikalien sorgen dafür, daß die Propeller an das Enzym ATPase andocken. Um die Motoren samt Propeller zu testen, werden sie auf 80 nm breite und 200 nm hohe Sockel montiert und in eine Lösung aus ATP und anderen Chemikalien getaucht.
Auf dem Foto sind zu sehen: eine elektronenmikroskopische Aufnahme der nanofabrizierten Nickel-Sockel (A), eine Zeichnung des biomolekularen ATPase-Motors (B), eine Aufnahme der ebenfalls nanofabrizierten Nickel-Propeller (C) sowie eine Zeichnung des montierten Motors (D).
Die Energie für den Antrieb der Propeller, die sich achtmal pro Sekunde drehen (andere Quellen: 3 – 4 U/s), entsteht aus einer chemischen Umwandlung, bei der ATP durch den Bruch einer Phosphatbindung zu Adenosin-Diphosphat (ADP) wird, was durch das Enzym ATPase beschleunigt wird. Damit läßt sich der Motor mit dem gleichen ,Treibstoff’ betreiben wie lebende Muskelzellen.
Zwar laufen bei den Tests einige der ATP-Motoren bis zu zweieinhalb Stunden, doch von den ersten 400 mit Propellern ausgestatteten Minimotoren arbeiten lediglich fünf. Bei einigen lösen sich Propeller oder Sockel, andere springen nicht an oder verklumpen miteinander. Nach dem Lösen dieser Probleme ist u.a. geplant, die Biomotoren mit Lichtenergie statt mit ATP anzutreiben.
Theoretische Modelle für solche ATP-Motoren hatten die Professoren Hong-Yung Wang und George Foster bereits 1998 an der University of California, Berkeley, entwickelt.
Die Forschungen werden mit einem erweiterten Team auch in den Folgejahren weitergetrieben, wobei 2002 über die erfolgreiche Steuerung einer biomolekular angetriebenen Nanovorrichtung mit einem gentechnisch konstruierten chemischen Schalter berichtet wird.
Prof. Montemagno erhält für seine Gesamtarbeit im Jahr 2003 den Feynman-Preis in Nanotechnologie. Gemeinsam mit Jeff Jianzhong Xi von der University of California, Los Angeles (UCLA) meldet er im Februar 2004, daß es nun gelungen sei, biologisch aktive, hybride Nano/Mikroroboter zu konstruieren, die von Kardiomyozyten (Herzmuskelzellen) angetrieben werden. Diese bringen den Vorteil mit, besonders ausdauernd zu sein.
Mikroroboter
(Grafik)
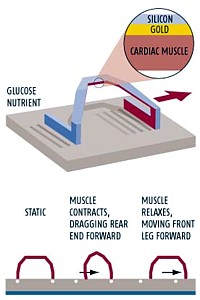
Für das Gerät wird ein Siliziumstab zu einem 50 µm weiten Bogen geformt und an der Unterseite mit einem Strang aus Herzmuskelfasern von Ratten verbunden. Die periodische Kontraktion und Entspannung dieser Muskelfasern, die nicht auf einem Punkt erfolgen, sondern in gerichtete Bewegung umgesetzt werden, beugen die Struktur und sorgen dafür, daß der ,Muskelbot’ mit einer Geschwindigkeit von 40 µm/s vorwärts kriecht. Unter dem Mikroskop ist klar zu sehen, wie sich der winzige zweibeinige Roboter voranbewegt.
Der Siliziumbogen des Geräts mit der Hälfte der Breite eines menschlichen Haares, der mittels gängiger Maschinen aus der Mikrochip-Produktion gefertigt und mit Kunststoff beschichtet wird, besitzt an der Unterseite einen Goldstreifen für die Verbindung mit den Muskelzellen. Um den Muskel wachsen zu lassen, wird der Bogen in eine Petrischale mit Muskelzellen in einer Glukose-Nährlösung gelegt, wo es drei Tage dauert, bis die Zellen zu einer Muskelfaser heranwachsen, die sich mit den Enden des Bogens verbindet.

aus Herzmuskelzellen
Da ein großer Vorteil eines solchen Motors darin besteht, daß er selbst keine Elektrizität benötigt, sondern die nötige Energie aus Glukose beziehen kann, hofft Montemagno, daß diese Technologie Menschen mit beschädigten Zwerchfellnerven helfen könnte, ohne künstliche Beatmung auszukommen. Statt die Beine eines Roboters zu bewegen, würden die Muskelfasern piezoelektrisches Material biegen und dadurch einige Millivolt Strom erzeugen, mit denen die Zwerchfellnerven dann stimuliert werden können. Die Glukose für die Energieversorgung kann dabei dem Blutkreislauf des Patienten entnommen werden.
Die NASA, die Montemagno den entsprechenden Forschungsauftrag erteilt hat, denkt allerdings an eine andere Anwendung: Ganze Schwärme solcher muskelbetriebener Mikroroboter sollen eines Tages Löcher in Raumschiffen und Raumstationen stopfen, die durch Mikrometeoriten verursacht werden.
Im Januar 2005 folgt die Meldung, daß das Team zwischenzeitlich ein neues System für den Zusammenbau mit Muskelkraft betriebener Mikrovorrichtungen entwickelt habe, da die aktuellen Verfahren für die manuelle Extraktion und anschließende Integration von Muskelgewebe in mikromechanische Strukturen zeitaufwendig ist und die lebendigen Komponenten dabei leicht beschädigt werden können.
Um diese Einschränkungen zu überwinden, basiert das neue System auf sinnvollen Manipulationen der Materialphasen und Schnittstellen. Dabei wachsen einzelne Zellen und organisieren sich selbst zu Muskelbündeln, die mit mikromechanischen Strukturen integriert sind und eine kontrollierbare, freie Bewegung ermöglichen. Nach der Realisation einer solchen Anordnung aus Herzmuskelzellen zeigen die Forscher zwei Anwendungsmöglichkeiten.
Diese sind ein Kraftwandler, der die mechanischen Eigenschaften des Muskels in situ charakterisieren kann, sowie eine selbstorganisierte, hybride organisch/anorganische Mikrovorrichtung, die sich als Folge der kollektiven kooperativen Kontraktion der Muskelbündel voranbewegt. Da die Herstellung von Mikrovorrichtungen aus Silizium in diesem Fall unabhängig von der späteren Montage der Muskelzellen ist, gilt dieses System als sehr vielseitig und könnte zur Integration von Zellen und Gewebe in eine Vielzahl von anderen Mikrostrukturen führen.
Im Jahr 2010 arbeitet Montemagno übrigens gemeinsam mit Prof. David Wendell und weiteren Kollegen der University of Cincinnati an der Erzeugung eines künstlichen Photosynthesematerials aus einem Schaum, der mit Enzymen injiziert wird, welche in Kombination mit Sonneneinstrahlung CO2 in Sauerstoff und Zucker umwandeln (s.d.). Später wird Montemagno zum Direktor des Ingenuity Lab an der University of Alberta berufen, er stirbt im Oktober 2018.
(Grafik)
Unter Vorwegname der Chronologie ist an dieser Stelle wohl der passende
Ort, um auf eine weitere interessante Entwicklung hinzuweisen,
die auf ATP basiert.
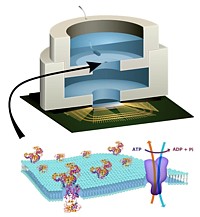
Im Dezember 2015 berichten Wissenschaftler der Columbia University um Prof. Ken Shepard, daß sie einen chemische Energie produzierenden biologischen Prozeß erfolgreich dazu genutzt haben, ein Festkörper-Halbleiterbauelement (CMOS) mit Strom zu versorgen, was auch eine Weltpremiere sei.
Die Forscher entwickeln das System mittels einer künstlich erzeugten Lipid-Doppelschicht-Membran, die natürlich vorkommende Ionenpumpen enthält, welche durch das biologische Energie-Molekül ATP angetrieben werden. Shepard zufolge würden Ionenpumpen sehr ähnlich wie Transistoren funktionieren. Die verwendete Art von Pumpe erzeugt über die künstliche Lipidmembran ein echtes Potential, das abgegriffen und zur Versorgung des IC genutzt wird.

Im Gegensatz zu den bisherigen Ansätzen, die mit unterschiedlichem Erfolg versucht hatten, ganze lebende Systeme mit Chips zu verbinden, wird bei dem neuen Ansatz nicht die ganze Zelle benötigt, sondern nur die Komponenten der Zelle, welche die erforderliche Arbeit tun. Dafür werden die ATPasen isoliert, weil sie die Proteine sind, die es erlauben, Energie aus ATP zu extrahieren. Die wichtigsten Herausforderungen sind jetzt, zu versuchen das System zu verkleinern, sowie Wege zu finden, den biologischen Zerfall in den Griff zu bekommen.
Neuigkeiten gibt es im Mai 2021, als das Team der Columbia University das weltweit bislang kleinste Single-Chip-System präsentiert, das eine vollständig funktionierende elektronische Schaltung darstellt. Der implantierbare Chip ist nur unter einem Mikroskop sichtbar. Um das Gerät drahtlos mit Energie zu versorgen und mit ihm zu kommunizieren, nutzt das Team Ultraschall – weshalb die Sache in dem entsprechenden Kapitelteil weiter behandelt wird (s.d.).

(Grafik)
Zwar noch nicht umgesetzt, aber dennoch äußerst interessant
- wenn nicht sogar genial -, ist das Konzept von Michael
Stabile aus
den USA. Unter dem Titel Blink bildet es seine Beteiligung
an dem Pop Sci and Core77 Wettbewerb des Jahres 2003.
Dabei geht es um Nachtsicht-Kontaklinsen (Night-Vision Contacts, NVC) – und um deren Versorgung mit der notwendigen Energie zur Verstärkung des einfallenden Lichts. Dies soll erfolgen, indem eine dünne Schicht aus Neodym-Eisen-Bor (NdFeB) Gel außen auf das Augenlied gestrichen wird. NdFeB ist der stärkste heute existierende Seltene-Erden-Magnet.
Jedes Blinzeln bewegt das Magnetmaterial an der mehrschichtigen Kontaktlinse vorbei und induziert dadurch die erforderliche elektrische Ladung. Leider scheint die Enzwicklung nicht weiter verfolgt worden zu sein. Die weiteren Entwicklungen im Bereich der elektronischen Kontaklinsen behandle ich in einem gesonderten Kapitelteil (s.d.).

Die Idee, das Blinzeln zur Energieerzeugung zu nutzen, kommt ein weiteres
Mal im August 2014 ins Gespräch, als die Industriedesignerin Naomi
Kizhner am Hadassah College in Jerusalem
ihre Abschlußarbeit vorstellt. Diese besteht nämlich aus einer Reihe
von Schmuckstücken, die allesamt die Energie ihrer Trägerin ernten.
Dazu gehört auch der Blinker, der auf dem Nasenrücken und über den Augenlidern sitzt, um die kinetische Energie der Bewegungen von Augen und Wimpern zu nutzen. Warum die Designerin dabei allerdings so ernst guckt, habe ich nicht herausfinden können.
Neben diesem Entwurf (der tatsächlich aber nicht funktionsfähig ist) zeigt Kizhner noch weitere Schmuckstücke, die ebenfalls in erster Linie als Gedankenexperimente für die spannende Diskussion dienen sollen, wie weit zu gehen Menschen bereit sind, um an Energie zu kommen. Über ihr Modell Blood Bridge berichte ich weiter unten unter Strömung.
Weiter mit den muskulären Systemen...