 TEIL C
TEIL C
WASSERSTOFF
„Das 21. Jahrhundert wird das Zeitalter des solaren Wasserstoffs.“
Dr. Ludwig Bölkow
„Der höhere Preis für Wasserstoff zahlt sich durch seine absolute Umweltfreundlichkeit wieder aus. Wenn man zum gegenwärtigen Benzinpreis auch die Entwicklungs- und Folgekosten für Katalysatoren und die Reparaturkosten für die Natur hinzurechnet, wäre Wasserstoff heute schon billiger als Benzin.“
Prof. Dr.-Ing. Walter Peschka
„Niemand darf erwarten, daß die Wasserstoffwirtschaft uns billigere Energie beschert als heute. Eher dürfte das Gegenteil der Fall sein.“
Andreas Troge, Präsident des UBA
Geschichtlicher Rückblick
Die Bezeichnung Wasserstoff existiert seit 1787. Der Franzose Lavoisier ‚taufte’ den Wasserstoff als ‚hydrogène’ (hydor = Wasser, griechisch; genes = erzeugend), also ‚Wasser-Bildner’. Wasserstoff selbst ist ein Molekül aus zwei Wasserstoffatomen (H2) und unseres Wissens das häufigste Element im Weltall. Es ist auch das leichteste aller Elemente. Trotzdem setzt ein Kilogramm H2 bei der Verbrennung 33 kWh elektrische Energie frei, dreimal soviel wie Benzin. Schon 1874 ließ Jules Verne seinen Helden Cyrus Smith in dem Roman ‚Die geheimnisvolle Insel’ davon träumen, die Energie des Gases Wasserstoff zu nutzen.
Die wohl erste ‚technische Nutzung’ des Wasserstoffs läßt sich jedoch schon auf den 1. Dezember 1783 datieren, als der französische Physiker Jacques Alexandre César Charles (1746 – 1823) gemeinsam mit seinem Kollegen Professor Robert in den Tuilerien zum ersten Mal in einem wasserstoff-gefüllten Ballon von der Erde abhob. Der Ballon stieg auf 250 m und legte eine Strecke von rund 43 km zurück. Dann setzte Charles seinen Beifahrer ab und stieg mit seinem Ballon auf 2.770 m Höhe. Seinen Ballon, die Charlière hatte er aus Seide gefertigt. Das Gewebe war komplett mit Kautschuk abgedichtet, und der mit Wasserstoff gefüllte Ballon von einem Netz umgeben, an das ein kleines Boot gehängt wurde. Ein wahrlich frühes Beispiel für die Verbindung von Wasserstoff und Mobilität!

Im Rahmen der globalen Energiediskussion tritt dieses Element neuerdings verstärkt als ‚synthetischer Kraftstoff’ auf. Oft wird dabei jedoch vergessen, daß es sich beim Wasserstoff nur um einen relativ leicht zu transportierenden und zu speichernden Sekundärenergieträger handelt, während zu seiner Herstellung sogar große Mengen an Primärenergie notwendig sind. Die besondere öffentliche Beachtung des Wasserstoffs erklärt sich aber auch daher, daß er zunehmend als Kraftstoff für Fahrzeuge eingesetzt wird – und die selbstbestimmte Mobilität im eigenen Wagen nun einmal eine der höchstbewerteten Attribute unserer modernen Gesellschaft ist.
Wasserstoff kann aber trotzdem zu den ‚Alternativ-Energien’ gezählt werden, weil zu seiner Herstellung ja auch erneuerbare Energieträger in Frage kommen (Sonne, Wind, Gezeiten usw.). Immer wieder wurden Zukunftsvisionen ausgemalt, bei denen riesige Solaranlagen in Nordafrika und im Nahen Osten aus Mittelmeerwasser den in Europa benötigten Wasserstoff produzieren.
Die positiven Seiten des Wasserstoffs sind:
Sein ‚Ausgangs-Rohstoff’ Wasser ist in praktisch unbegrenzten Mengen vorhanden, bei seiner Verbrennung entsteht hauptsächlich wiederum Wasser, das dem Auspuff entweicht, selbst ein gewöhnlicher Automotor kann ohne Probleme mit dem reinen Gas oder auch mit einem Wasserstoff/Benzin-Gemisch betrieben werden, Wasserstoff läßt sich relativ problemlos in besonderen, ihn aufsaugenden Metallen speichern, aus denen er durch Wärmezufuhr wieder freigesetzt wird, durch sein leichtes spezifisches Gewicht fließt er in Pipelines 3 Mal so schnell wie Erdgas, 1 Liter Wasserstoff beinhaltet etwa das 2,75-fache an freisetzbarer Wärmeenergie wie die gleiche Menge Benzin, seine Transportgefährdung ist relativ gering, weil sich Wasserstoff schnell verflüchtigt (sofern er allerdings nicht auf einen Schlag explodiert, was ebenfalls möglich ist), seine Umweltbelastung macht nur etwa 10 % der derzeit üblichen Stickstoffoxid-Mengen aus.
Für die Herstellung von Wasserstoff gibt es viele bereits genutzte – und noch mehr theoretische oder sich im Versuchsstadium befindliche Methoden. Außenseiter, die in der Datenbank der neuen Energie ihre Erwähnung finden, arbeiten auch mit Resonanzverfahren, starken Magnetfeldern, Hoch- und Höchstfrequenzen wie Mikrowellen oder gepulsten Verfahren mit Hochspannung.
Zur Zeit wird der Wasserstoff nahezu ausschließlich aus fossilen Energieträgern gewonnen, und am kostengünstigsten gilt das ‚Wasserdampf-Reforming’ von Erdgas. Der Anteil des aus fossilen Quellen gewonnenen Wasserstoffs an der weltweiten Gesamtproduktion beläuft sich 2004 auf knapp 40 %. Hierbei ist Wasserstoff allerdings zumeist ein Nebenprodukt der chemischen Industrie bei der PVC-Herstellung und der Rohölraffinerie. Der Wasserstoff entsteht dabei durch Dampfreformierung von Erdgas, durch partielle Oxidation schwerer Kohlenwasserstoffe oder durch partielle Oxidation von Kohle. Eine Wasserstofferzeugung mit diesen Verfahren für die Bereitstellung des Wasserstoffs als Energieträger für den mobilen Einsatz ist jedoch aus umweltspezifischen Gesichtspunkten (CO2-Emissionen bei der Herstellung) nicht vertretbar.
Die anderen Methoden sollen hier nur kurz überflogen werden, die Details dazu finden sich in den entsprechenden Fachbüchern (das grundsätzliche Prinzip der Elektrolyse werde ich weiter unten im Zuge der ‚Brennstoffzelle’ noch ausführlicher beschreiben).
Anmerkung: Stand der Recherche ist Anfang 2007 - und inzwischen liegen mir schon Berge an neuen Informationen vor, die ich alleine aber nicht (mehr) bewältigen kann. Ein entsprechendes Update kann daher erst vorgelegt werden, wenn sich Kooautoren an dieser Arbeit beteiligen.
Herstellung von Wasserstoff
Es gibt eine ganze Reihe von Methoden mit sehr verschiedenen Wirkungsgraden und auf unterschiedlichem Entwicklungsstand:
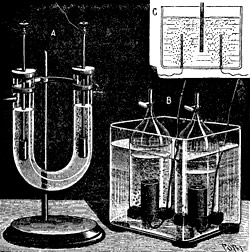
1) Die Elektrolyse von Wasser, Wirkungsgrad etwa 75 %, Forschungsziel 95 %, erreichbar durch höheren Druck und höhere Temperatur, durch bessere Elektroden und geringere Polarisation.

Wasser-Elektrolyseur
2) Die Hochtemperatur-Elektrolyse von Wasserdampf, Wirkungsgrade bis 90 % bei Temperaturen zwischen 800°C und 1.000°C. Unter Einsatz von Elektrolyt-Flüssigkeiten wird dabei hauptsächlich die abnehmende Zersetzungsspannung des Wassers bei steigenden Temperaturen ausgenutzt. Von der Firma Dornier GmbH wird 1987 gemeinsam mit den Partnern Lurgi und Bosch ein Verfahren mit dem Namen ‚Hot Elly’ entwickelt, das sich durch geringeren Stromverbrauch und längere Lebensdauer auszeichnet. Die keramische Hochtemperatur-Elektrolyse arbeitet mit Wasserdampf bei Temperaturen zwischen 900°C und 1.000°C, und statt den üblichen 500 – 700 Betriebsstunden erreicht es bis zu 3.000 Betriebsstunden. Der Energieaufwand liegt dadurch um 30 – 50 % niedriger als bisher. Die Kernelement dieses Verfahrens sind Keramikröhren aus Zirkonoxid, das mit dem Element Yttrium dotiert (gezielt verunreinigt) wird. Die Elektroden innen und außen bestehen aus einem anderen keramischen Material, das dem der neuen Supraleiter ähnlich ist. An die Elektroden ist eine Gleichspannungsquelle angeschlossen, und der fließende Strom spaltet die Moleküle in Wasser- und Sauerstoff. Das dotierte Zirkonoxid trennt schließlich die beiden Gase. Umweltgefährdende Elektrolyt-Chemikalien kommen nicht zum Einsatz.
3) Forscher beim US-Technologiekonzern GE stellen 2005 den Prototyp einer unkompliziert herstellbaren Elektrolyse-Maschine vor, mit der Wasserstoff mit Hilfe der Elektrolyse für ungefähr 3 $ pro Kilogramm herstellbar sein soll, während man mit anderen gängigen Wasserstoff-Produktionsverfahren noch mindestens 8 $ pro Kilogramm bezahlt. Der Trick dabei besteht darin, statt den von Hand zusammengenieteten, teueren Metallplatten der Elektrolyse-Kammer ein von GE entwickeltes und leicht formbares Kunststoff-Material namens ‚Noryl’ einzusetzen, das nicht gegen das hochalkalische Kalium-Hydroxid anfällig ist. Außerdem wird Reaktionsfähigkeit der Oberfläche der Metallelektroden gesteigert, in dem diese mit einem selbst entwickelten Nickel-basierten Katalysator Sprühbezug überzogen werden, der eine große Oberfläche besitzt. GE arbeitet an einem Produktionsmodul, mit dem sich ein Kilogramm Wasserstoff pro Stunde produzieren lassen, und das schon in ein paar Jahren in Produktion gehen soll.
4) Die Elektrolyse mit einem Solid-Polymer-Elektrolyten, wobei eine wenige Zehntel Millimeter dicke Ionenaustauscherfolie wie z.B. ‚Nafion’ als Elektrolyt verwendet wird. Bei diesem Verfahren wird eine wesentlich höhere Stromdichte als bei der konventionellen Elektrolyse erreicht.
5) Bei dem sich in der Pilotphase befindenden Kvaerner-Verfahren im Plasmabogen werden die Kohlenwasserstoffe bei 1.600°C unter Zugabe von Energie in Reinstkohle und Wasserstoff getrennt. Dieses Verfahren hat unter Berücksichtigung aller verwertbaren Produkte einen Wirkungsgrad von nahezu 100 % und es treten auch keine nennenswerten Emissionen auf. Der Energiebedarf des Verfahrens ist jedoch sehr hoch.
6) Eines der wichtigsten regenerativen Verfahren der Wasserstoffherstellung ist die Vergasung und Pyrolyse von Biomasse mit anschließender Shiftreaktion (Konvertierung von Kohlenmonoxid und Wasserdampf in Kohlendioxid und Wasserstoff). Auf dem Markt sind Verfahren zur Erzeugung von Wasserstoff aus Biomasse jedoch noch nicht erhältlich. Beim Verfahren der Wasserdampfvergasung von Biomasse fallen im ersten Schritt Koks, Methanol und Faulgase an, welche im zweiten Schritt mit Sauerstoff und Wasserdampf zu einem wasserstoffreichen Mischgas reagieren.
7) Die Virent Energy Systems aus Madison im US-Bundesstaat Washington entwickelt eine weitere Methode, Wasserstoff preiswert und umweltschonend aus Biomasse herzustellen. Mitte 2006 wird die Technik erstmals zum Betrieb eines 10 kW Generators eingesetzt, wobei der Biomasse-Ausgangsstoff schlichter Maissirup ist. Der Virent-Prozeß, die so genannte wässrige Phasenumformung (APR), kommt mit einer relativ niedrigen Temperatur aus und die zum Einsatz kommenden aktiven Katalysatoren können zudem bis zu 15 Mal mehr Wasserstoff pro Gramm umwandeln, als bei der Dampfumformung. Das Ausgangsmaterial lässt sich so zu 90 % im ersten Durchgang umwandeln, der Rest wird recycelt. Man erwartet daher, Wasserstoff für zwei bis 3 $ pro Kilogramm herstellen zu können. Das Unternehmen beteiligt sich außerdem an einem eine Million Dollar schweren Projekt der US-Marine, bei dem ein tragbarer Brennstoffzellen-Generator entstehen soll, der seinen eigenen Wasserstoff produziert – aus einer aus Biomasse hergestellten Glyzerin-Lösung. Möglicherweise läuft der neue Generator sogar mit einfachem Frostschutzmittel.
8) Die direkte thermische Wasserspaltung, die auf der Dissoziation des Wasser beruht, wobei üblicherweise mindestens 3.000°K erforderlich sind. Wissenschaftlern des Deutschen Zentrums für Luft- und Raumfahrt (DLR) gelingt es im Oktober 2004 erstmals, in dem Sonnenofen in Köln-Porz Wasserdampf durch konzentriertes Sonnenlicht thermisch zu spalten und dadurch solaren Wasserstoff zu erzeugen. Im Gegensatz zur direkten thermischen Wasserspaltung, die erst bei einigen Tausend Grad Celsius erfolgt, nutzt das neuartige Verfahren die Kombinationen verschiedener chemischer Reaktionen bei Temperaturen von unter 1.400°C. Bei diesen Reaktionen können auch alle verwendeten Chemikalien – außer dem eingesetzten Wasser und den produzierten Gasen Sauerstoff und Wasserstoff – zurückgewonnen und erneut eingesetzt werden.
9) Herstellung unter Nutzung von bestimmten Substanzen und Chemikalien als Katalysatoren. Das Unternehmen Texas Instruments gibt 1980 bekannt, in einem Zeitraum von vier Jahren eine ‚Halbleiter Elektrolytzelle’ marktfähig machen zu wollen. Diese Zelle besteht aus einem Glasrohr mit winzigen Siliziumkügelchen, die direkt auf einer Metallelektrode befestigt sind und bei Lichtzufuhr aus einer umgebenden Jodwasserstofflösung den Wasserstoff abspalten.
10) Wissenschaftler der A & M University in Texas entwickeln 1982 eine Methode, bei der Silizium-Kristalle mit einer Platinbeschichtung als Elektrode als Sammelort für Wasserstoffatome fungieren. Neben dem Wirkungsgrad von 12 – 13 % bilden die niedrigen Kosten und eine höhere Wirtschaftlichkeit die Besonderheiten dieser Methode.
11) Im Jahr 1998 berichteten Forscher der Spanischen Universität Valencia von einer neuen Katalysatorentwicklung aus dem Metall Molybdän.
12) Bei dem HYDROSOL genannten zweistufigen Prozeß auf Basis eines Metalloxid-Systems wird Sauerstoff aus Wassermolekülen abspalten und reversibel in seine Kristallstruktur eingebunden, wobei das Metalloxid während des gesamten Prozesses auf der Oberfläche einer keramischen Trägerstruktur fixiert bleibt. Im ersten Schritt wird der am Metalloxid vorbeiströmende heiße Wasserdampf durch Bindung des Sauerstoffs an das angeregte Metalloxidgitter bei Temperaturen von etwa 600°C bis 800°C gespalten und Wasserstoff freigesetzt. Beim zweiten Schritt wird bei Temperaturen von 1.200°C bis 1.300°C der zuvor in das Gitter eingebaute Sauerstoff wieder abgegeben und das Metalloxid regeneriert.
Der Sonnenofen fungiert dabei als Modell für ein späteres Solarturmsystem, das zum Betreiben der genannten Prozesse im technischen Maßstab zum Einsatz kommen soll. Bei diesem Projekt kooperiert das DLR mit den Partnern CERTH/CPERI aus Griechenland, Johnson Matthey Fuel Cells Ltd. aus Großbritannien und Heliotech Aps aus Dänemark.
13) Auch Wissenschaftler vom Institut für Anorganische und Analytische Chemie der Universität Jena nutzen Licht, um Elektronen gezielt von einer Untereinheit dieses Moleküls zu einer anderen springen zu lassen. Dadurch entsteht am Ende der Reaktion molekularer Wasserstoff. Im September 2006 geben sie bekannt, dabei eine weltweit einmalig hohen Ausbeute erreicht zu haben. In einem der Natur nachempfundenen Prozeß, bei dem die Reaktion in einem einzigen Molekül abläuft, erzeugen sie den molekularen Wasserstoff mittels einem speziellen Katalysator, der in jahrelanger Synthesearbeit hierfür entwickelt wurde.
Wie bei der Photosynthese hat der Prozess, den die Chemiker im Labor ablaufen lassen, zwei wesentliche Stationen: Ein spezieller Metallkomplex mit Ruthenium als ausschlaggebendem Bestandteil dient als Antenne, die das Licht einfängt. Das Ruthenium gibt daraufhin ein Elektron ab, das auf das Reaktionszentrum springt, dessen Kern ein Palladiumatom bildet. An diesem Metallzentrum wird schließlich Wasserstoff gebildet. Schon heute hält das Team den Weltrekord bei der Wasserstoffgewinnung mit einem Molekül – es erhält 56 Moleküle Wasserstoff pro Katalysatormolekül. Weltweit beherrschen nur zwei weitere Forschergruppen diesen Ansatz.
Um die Reaktion weiter zu optimieren und so die höchstmögliche Energieausbeute zu erzielen, werden in enger Kooperation mit dem Institut für Physikalische Chemie der Universität Jena (IPC) und dem Institut für Physikalische Hochtechnologie (IPHT) weitere Arbeitsschritte unter Anwendung Laser-spektroskopischer und subtiler quantentheoretischer Methoden durchgeführt. Außerdem soll in der Zukunft das heute noch notwenige Triethylamin durch andere Substanzen ersetzt werden.
14) Im November 2006 veröffentlichen Wissenschaftler der University of Minnesota einen verbesserten Katalyse-Prozeß, mit dem sich Wasserstoff aus Sojaöl und sogar aus Zuckerwasser herstellen läßt. Paßst man die Menge an eingelassenem Sauerstoff an, soll sich mit dem neuen Prozeß aus Sojaöl oder Zuckerwasser das sogenannte ‚Syngas’ erzeugen lassen (eine Mixtur aus Kohlenmonoxid und Wasserstoff), die sich entweder als Brennstoff direkt verwenden oder in synthetisches Benzin umwandeln läßt.
Der neue Katalyse-Prozeß beginnt mit dem Einspritzen feiner Tröpfchen Sojaöl oder Zuckerwasser in einen enorm heißen Katalysator, der aus kleinen Mengen an Cer und Rhodium besteht. Die schnelle Erhitzung sorgt in Verbindung mit Katalyse-unterstützten Reaktionen dafür, daß es nicht zu einer Kohlenstoffanreicherung kommt, die den Prozeß ausbremsen würde. Die dabei ablaufenden Reaktionen produzieren Hitze, was den Katalysator wiederum heiß genug hält, sie ohne zusätzliche Energiezufuhr weiter in Gang zu halten, während fossile Brennstoffe nur beim Anfahren der Anlage benötigt werden, um die Katalyse auf ihre Arbeitstemperatur von 800°C zu bringen.
Der Schlüssel zu einer besonders schnellen Reaktion sind die kleinen Tröpfchen. Bereits existierende Prozesse zur Umwandlung flüchtiger Brennstoffe wie Ethanol oder Biodiesel zu Wasserstoff sind eher langsamer, weil sich die Brennstoffe in Röhren befinden und es bis zu eine Sekunde dauert, sie zu transportieren. Bei der neuen Erfindung heizen sich die Tröpfchen hingegen in wenigen Millisekunden auf, was das das ganze System schneller, billiger und kleiner macht. So könnte es sogar praktikabel werden, daß ein Bauer ein kleines System auf seinem Hof betreibt. Die Technik soll derzeit aber noch nicht kommerzialisiert werden, da die Forscher das System erst an andere Biomasse-Quellen anpassen möchten.

15) Die Hybridverfahren bilden Kombinationen von Elektrolyse und thermoschemischen Verfahren.
16) Die Biophotolyse, die bakterielle Wasserspaltung oder die Nutzung der Photosynthese mittels Bakterien oder Algenkulturen, deren H2 produzierenden Enzyme aktiviert werden sollen (s.a. unter ‚Sonnenenergie’). Erstmals entdeckt wurde die Wasserstofferzeugung durch Pflanzen schon in den 30er Jahren des letzten Jahrhunderts vom deutschen Forscher Hans Gaffron. Inzwischen laufen Versuche, die pflanzenimmanente Lichtreaktion (Spaltung von H2O in Elektronen und H2-Ionen) von der ebenfalls immanenten Dunkelreaktion trennen, womit der Aufbau von Stärke und Zellulose verhindert werden könnte. Untersuchungen am Pigment Rhodopsin (Sehpurpur), das an den Sehvorgängen im Auge beteiligt ist, führen 1983 zur Entdeckung, daß auf dem Eiweißstoff Bakteriorhodopsin basierende Solarzellen Licht in chemische Energie umwandeln können, Wasser wird in O2 und H2 gespalten. Der theoretische Wirkungsgrad liegt bei 60 %. Wichtig ist hier auch die – im Gegensatz zu anderen biologischen Solarzellen – hohe Widerstandsfähigkeit des Stoffes gegenüber der dauernden Lichtbelastung.
17) Bei ähnlichen Untersuchungen an der Universität von Nebraska wird 1985 festgestellt, daß in den membranartigen Schichten der Pflanzenzell-Chloroplasten Mangan als katalytischer Wirkstoff eine besondere Rolle spielt. Man hofft aufgrund dieser Erkenntnisse, künstliche Membranen zu konzipieren und zusammen mit eingelagertem Mangan wasserspaltende Solarzellen konstruieren zu können. 1989 beschließt das BMFT, die Untersuchungen zur biologischen Wasserstoffgewinnung mit Hilfe des Photosyntheseapparates der grünen Pflanzen oder der Blaualgen bis 1993 mit insgesamt 22 Mio. DM zu fördern. Dabei soll u.a. das Algen-Enzym Hydrogenase gentechnisch so verändert werden, daß sie den Wasserstoff in großem Maßstab und wirtschaftlich produzieren. Hauptprobleme der Biophotolyse sind zu diesem Zeitpunkt der niedrige Wirkungsgrad (theoretisch 14 %, erreicht werden zumeist aber nur weniger als 1 %) und die komplizierte Trennung von Wasserstoff und Sauerstoff.
18) Mitte der 1990er Jahre experimentiert man an der TU Berlin immer noch mit verschiedenen Purpurbakterien aus Marokko, Guyana, Italien und Algerien, wobei es darum geht, diese Bakterien durch Reduzierung der Luftstickstoffzufuhr zu einer erhöhten Wasserstoffproduktion anzuregen. Im Rahmen der photobiologischen Wasserstofferzeugung durch Photosynthese oder Fermentation werden von der Fachabteilung Bionik und Evolutionstechnik Versuche zur Artifiziellen Bakterien-Algen-Symbiose mit der Blaualge Nostoc muscorum durchgeführt, deren vegetative Zellen und Heterozysten eine Art biologisches ‚Haber-Bosch-Verfahren’ betreiben können. Fehlt es am Synthesepartner Stickstoff, wird Wasserstoff freigesetzt.
19) 1996 entwickeln Forscher der Rheinisch-Westfälischen Technischen Hochschule in Aachen (RWTH) einen Photo-Bio-Testreaktor, in dem Grünalgen rund zwei Liter Wasserstoff pro Quadratmeter und Stunde erzeugen. Wissenschaftler der Berkeley University in Kalifornien entdecken dann im Jahr 2000, daß die Grünalge Chlamydomonas reinhardtii in einer schwefelarmen Umgebung besonders viel Wasserstoff liefert. Das Enzym Reversible Hydrogenase von einem Liter Algen kann in vier Tagen 160 Kubikzentimeter Wasserstoff erzeugen – soviel wie für den Betrieb einer kleinen Leuchtdiode benötigt wird.
20) Ein anderer Bioreaktor wird 1996 von einem Team des US-amerikanischen Oak Ridge National Laboratory entwickelt, in dem eine Kombination von Enzymen die Glucose aus Holzschnitzeln, Altpapier oder Pflanzenresten abbauen und Wasserstoff freisetzen. Ein positives Nebenprodukt dieses Verfahrens ist die Gluconsäure, die in der Metallverarbeitung, der Textil- und Nahrungsmittelindustrie verwendet wird.
21) 1998 bestimmen Forscher der Utah State University erstmals Struktur und Funktion des sogenannten Cpl-Enzyms des Bakteriums Clostridium pasteurianum, das 20 pilzförmig angeordnete Eisenatome als Katalysatoren nutzt, um aus Protonen und Elektronen molekularen Wasserstoff zu erzeugen.
22) Die Forscher Rüdiger Schulz-Friedrich und Thorsten Heidorn vom Botanischen Institut der Christian-Albrechts-Universität stellen auf der Messe BioTechnica in Hannover im Oktober 2003 ein weiteres Verfahren zur Wasserstoff-Erzeugung vor. Ausgangspunkt sind Mikroalgen wie einzellige Grünalgen oder Cyanobakterien, die in einem Reaktor dem Sonnenlicht ausgesetzt werden. Dabei kommt eine Photosynthese in Gang, die unter speziellen Bedingungen auch Wasserstoff erzeugt.
23) Im September 2003 entwickeln Derek Lovley und andere Forscher an der Universität von Massachussetts-Amherst ein biotechnologisches Verfahren, um mit Hilfe des Bakteriums Rhodoferax ferrireducens Zucker direkt (und kontinuierlich über einen längeren Zeitraum) in Elektrizität umzuwandeln.
24) 2006 experimentiert auch Tasios Melis von der Universität von Berkeley in Kalifornien damit, Pflanzen zu veranlassen, statt Kohlendioxid per Photosynthese Wasser zu zerlegen, um entsprechende Wasserstoff-Farmen zu konzipieren. Der Forscher denkt an durchsichtige Kunststoffröhren, die sich über die endlosen Salzflächen der südkalifornischen Wüsten erstrecken. Diese wassergefüllten Röhren würden dann die mikroskopisch kleinen Algen enthalten, die das Sonnenlicht zur Generierung von Wasserstoff verwenden. Gerade der weiße Salzboden der ausgetrockneten kalifornischen Wüstenseen würde die Effizienz der Anlagen sogar noch erhöhen, da er das Sonnenlicht besonders stark reflektiert und die Kunststoffröhren somit von beiden Seiten gut belichtet würden.
25) Etliche Forscher arbeiten daran, die passenden Mikroorganismen entweder durch Genmanipulation an den verwendeten Chlamydomonas reinhardtii zu erreichen, oder durch spezielle Nährböden. Auch das amerikanische Energieministerium investiert jährlich einige Millionen Dollar in diese Forschungen. 2006 hat die Wasserstofferzeugung aus Algen eine Effizienz von unter 0,1 %, während eine kommerzielle Nutzung etwa 10 % Effizienz erforderlich machen würde. Bis 2015 soll der Preis pro Kilogramm Algen-Wasserstoff auf 3 $ sinken, womit er kommerziell konkurrenzfähig würde. Langfristig könnten sogar 1,40 $ möglich sein.
26) Im Juni 2003 entwickelt ein Team um Professor James Dumesic von der University of Wisconsin-Madison eine einfache und effektive Methode, aus biologischen Abfällen Wasserstoff zu gewinnen. Dabei wird ein einstufiger katalytischer Prozeß genutzt, der bei niedrigen Temperaturen abläuft und die Wasserstoffherstellung aus Zucker, Äthylenglykol und Methan erlaubt. Um die Technologie kommerziell umzusetzen gründen die Wissenschaftler ein eigenes Unternehmen, die Virent Energy Systems. Das System ist sowohl für den Einsatz in Mikrochip-Größe als auch auf großindustriellem Niveau geeignet.
27) Die Photoelektrolyse, die lichtinduzierte Ladungsverschiebung (auch: photoelektrischer Effekt, photochemische Zersetzung,), mittels photonenaktivierten Substanzen wie Strontiumtitanat, Der Wirkungsgrad liegt bisher erst bei rund 1 %. Es werden außerdem Versuche zur Entwicklung photoelektrochemischer Zellen durchgeführt, mit Halbleiterelektroden als Kathoden und Anoden, der hier erreichte Wirkungsgrad beträgt bislang etwa 5 %.
28) Der Schweizer Forscher Michael Grätzel beleuchtete mit Sonnenlicht eine Lösung von Wasserstoffsulfid in Wasser, die mit Teilchen des Halbleiters Cadmiumsulfid versetzt sind – welche ihrerseits mit Rutheniumdioxid geladen sind. Dadurch wurde aus dem Wasser der Wasserstoff, und aus dem Wasserstoffsulfid der Schwefel elektrochemisch abgespalten. Dieses Verfahren von 1983 kommt ohne teure Platinkatalysatoren aus und bringt eine höhere Wasserstoffausbeute. Als Nebenprodukt ließe sich aus den in Ölraffinerien anfallenden und sonst kaum verwertbaren Wasserstoffsulfiden verkäuflicher Schwefel gewinnen.
Grätzel ist auch der Entwickler einer nach ihm benannten Farbstoff-Solarzelle.
29) Eine weitere Methode der Wasserstofferzeugung durch Wasserzerlegung beim Bestrahlung mit Sonnenlicht wird an der Universität von North Carolina untersucht. Dort benutzt man Monolayer-Dünnfilme, also extrem dünne Schichten verschiedener Rutheniumkomplexe. Es zeigt sich, daß neben dem platinähnlichen Ruthenium selbst auch dem Chlorophyll ähnelnde Metallkomplexe des Benzolabkömmlings Bipyridyl genutzt werden können. Das Sonnenlicht regt dabei den Elektronentransfer an, d.h. den Austausch subatomarer Partikel zwischen den Ruthenium-Komplexen und dem Wasser.
30) Forscher des National Renewable Energy Laboratory (NREL) in Golden, Colorado, stellen 1998 mit einem Wirkungsgrad von 12 % einen neuen (rechnerischen) Rekord bei der solaren Wasserspaltung auf, indem sie eine Tandemzelle aus einer Schicht Gallium-Indium-Phosphid und einer Schicht Gallium-Arsenid einsetzen, wobei der Wasserstoff direkt an der ersten Schicht erzeugt wird, während der Sauerstoff bei einer Platin-Elektrode abgegeben wird.
31) Bei der mechanisch-katalytischen Wasserspaltung, 1999 am Tokyo Institute of Technology entwickelt, wird Kupferoxidpulver in lauwarmes Wasser geschüttet und ordentlich durchgequirlt. Angeheizt durch das als Katalysator wirkende Oxid zerfallen die Wassermoleküle bei Zimmertemperatur und normalem Licht zu Wasserstoff und Sauerstoff. Als Wirkungsgrad dieses Verfahrens wurden 5 % angegeben. Weitere erfolgreiche Experimente werden mit einer Mischverbindung aus Eisen, Kupfer und Sauerstoff durchgeführt.
32) Es gibt noch weitere Methoden zur Herstellung des Wasserstoffs, z.B. als Nebenprodukt der Alkoholproduktion, durch Kohlevergasung (Erhitzung gemeinsam mit Wasserdampf und Sauerstoff), wobei eine 10 mal kleinere Umweltbelastung als bei direkter Wärmefreisetzung erreicht werden soll, durch eine partielle Verbrennung von Kohlewasserstoffen wie Butan, durch die katalytische Spaltung von Methan und anderen Kohlewasserstoffen, durch den thermochemischen Kreisprozeß (System Mark I, Mark IX bei Euratom/Ispra), durch die Nutzung von Intermetallphasen (LaNi5 / FeTi) oder auch mittels dem Schwefelhybridprozeß: Die Schwefelsäure zersetzt sich bei hohen Temperaturen zu H2O, SO2 und O2. Im darauf folgenden 2. elektrochemischen Schritt werden in einem Kreisprozeß SO2 und H2O zu Schwefelsäure und H2 zurückgeführt (KfA Jülich, 1986).
33) Auf dem Wasserstoffweltkongress in Lyon im Juni 2006 stellen Forscher der ETH Zürich ein neues, durchaus spektakuläres Verfahren zur Wasserstoffherstellung vor, bei dem ausschließlich Wasser und Hitze genutzt werden. Durch das konzentrieren von Sonnenlicht mit Spiegeln werden in einem chemischen Reaktor, der mit Zinkoxid gefüllt ist, Temperaturen von 2.000°C erreicht, wodurch das Zinkoxid in Zinkmetall und Sauerstoff gespalten wird. In einem zweiten Schritt läßt man das Zink mit Wasser reagieren, wodurch der Wasserstoff entsteht – und Zinkoxid, das wiederverwertet wird. Als Wirkungsgrad der zwei bislang gebauten Pilotanlagen werden über 50 % angegeben (zum Vergleich: der Wirkungsgrad der Elektrolyse mittels Solarzellenstrom erreicht höchstens 15 %). Die Forscher aus Zürich rechnen allerdings damit, daß es noch 10 bis 15 Jahre dauern wird, bis industrietaugliche Anlagen gebaut werden können. Warum eigentlich??
34) Im November 2006 stellen Wissenschaftler der University of Minnesota in Minneapolis ein der hydrothermalen Karbonisierung ähnliches Verfahren vor (s.u. ‚Separation aus Biomasse’), bei dem sie die Tatsache nutzen, daß sich große Moleküle durch Hitzeeinwirkung (Pyrolyse) sehr schnell in kleinere aufspalten lassen. Die Reaktionskammer der US-Wissenschaftler arbeitet bei Temperaturen um die 1.000°C. Dabei sprüht eine aus der Automobiltechnik bekannte Einspritzpumpe rund 400 Mikrometer große Tropfen des umzuwandelnden Stoffes, gemischt mit Sauerstoff, auf einen 1.000°C heißen Rhodium-Cer-Katalysator. Die durch die katalytische Reaktion frei werdende Energie reicht aus, um die Temperaturverhältnisse in der Reaktionskammer aufrechtzuerhalten und damit die Bildung von Kohlenstoffablagerungen wirksam zu verhindern. Das Resultat besteht zu 70 % aus Wasserstoff, während der Bio-Rohstoff dabei zu über 99 % umgesetzt wird. Bei ersten Versuchen läuft der Prozess erfolgreich über mehr als zwanzig Stunden, ohne daß der Katalysator an Wirksamkeit einbüßt. Die Forscher testen ihr Verfahren mit Sojaöl, Biodiesel und einer wässrigen Glukose-Lösung, der Methangaszugesetzt wurde, um eine optimale Verteilung von Kohlenstoff- und Wasserstoffatomen zu erreichen.
35) Anfang Dezember 2006 informiert das Imperial College London darüber, daß es im Zuge einer Zusammenarbeit mit Forschern der Waseda University in Japan gelungen sei, Albumin, ein Protein des Blutserums, und Porphyrin, ein sauerstofftransportierendes Molekül, das dem Blut auch seine rote Farbe gibt, zu einen langen Molekülkomplex zu kombinieren. Hierzu ersetzten sie ein Eisenatom aus dem Zentrum des Porphyrins durch ein Zinkatom, wodurch sich die gesamte Chemie und Verhaltensweise des Moleküls drastisch änderte. Das modifizierte Porphyrin wurde anschließend mit dem genetisch optimierten Albumin verbunden, und die neue Kombination ist in der Lage, Sonnenlicht zu nutzen, um Wasser in Wasserstoff und Sauerstoff zu zerlegen.
Eine ganze Reihe dieser Methoden wird wahrscheinlich nie zur praktischen Anwendung kommen, ihre Vielfalt zeigt jedoch, daß auf diesem Sektor ganz besonders intensiv geforscht und gearbeitet wird. Um die derzeitige Anwendung und Wichtigkeit des Wasserstoffs zu demonstrieren, sollen noch einige Zahlen genannt werden:
Der Weltverbrauch an Wasserstoff betrug im Jahre 1970 etwa 17,8 Mio. t, von denen der chemischen Industrie 72 % zufielen (besonders für die Ammoniaksynthese im Rahmen der Düngemittelproduktion). 1989 lag der Verbrauch bereits bei rund 32 Mio. t.
Noch 1976 wurden 99 % des Wasserstoffs unter Verwendung von fossilen Kohlewasserstoffen hergestellt, z.B. über die Dampf-Reformierung von Erdgas, über die Kohlevergasung usw. Auch das Stadtgas vieler Großstädte besteht heute schon zu einem überwiegenden Teil aus Wasserstoff. Im Jahre 1979 lag die Weltproduktion bei 200 Milliarden Kubikmetern, was energetisch dem Inhalt von 100 Mio. t Steinkohle entspricht.
Anfang März 1976 wurde in Miami Beach die 1. Welt-Wasserstoff-Energie-Konferenz abgehalten, Mitveranstalter war die ‚International Society for Hydrogen Energy’ mit Sitz in Coral Gables, Florida. Eine damals erschienene Bibliographie erwähnte schon 4.544 Veröffentlichungen zum Thema. Die Primärenergieträger, die seitens der Konferenz für die Wasserstoffherstellung in Betracht gezogen wurden, sind die folgenden:
Ein extrem wichtiger Punkt der Wasserstoff-Technologie ist die Speicherung dieses Stoffes. Die einzelnen Verfahren und Entwicklungen sind nachfolgend länderspezifisch zugeordnet, wobei es primär um die folgenden Methoden geht:
Bezüglich der letztgenannten Methode soll hier noch eine Entwicklung der Universität von Singapur erwähnt werden, wo 1999 die Wasserstoff-Speicherung in Nano-Röhrchen aus Kohlenstoff erfolgreich umgesetzt wird. Eine besonders hohe Speicherkapazität zeigen dabei mit Lithiumatomen gespickte Kohlenstoffröhrchen. Diese metallhaltigen Röhren können bei Normaldruck und Temperaturen um 300°C eine Wasserstoffmenge von einem Fünftel ihres Eigengewichtes aufnehmen. Bei allmählicher Erwärmung auf 500°C geben die Minispeicher das aufgenommenen Gas vollständig wieder ab.
Weitere Entwicklungen im Bereich der Wasserstoff-Speicherung finden sich in der nun folgenden Länderübersicht.
Für das Thema Wasserstoff und Brennstoffzelle empfehle ich die folgenden Seiten:
Die beiden Portale der Ludwig-Bölkow-Systemtechnik GmbH hyweb.de sowie h2mobility.org, die sich gezielt und auch ausführlich bebildert mit der Entwicklung Wasserstoff- bzw. Brennstoffzellen-betriebener Fahrzeuge befaßt.
Als nächstes folgt hier nun die Länderübersicht in Verbindung mit der Produktion und dem Einsatz von Wasserstoff.
