Buch der Synergie

| Blättern |
 TEIL C
TEIL C
MICRO ENERGY HARVESTING
Bakterielle
Systeme (V)
Das Thema wird in den Folgejahren immer intensiver bearbeitet, weshalb
ich mich in der weiteren Chronologie nur noch auf wesentliche Entwicklungsschritte
konzentrieren werde.
Die im Februar 2017 veröffentlichte Studie ‚A Ferrocene-Based
Conjugated Oligoelectrolyte Catalyzes Bacterial Electrode Respiration‘
der University of California, Santa Barbara (UCSB) befaßt
sich mit dem Bakterium Shewanella oneidensis, das ein Schwermetallfan
ist und Geschmack an Eisen, Blei und Quecksilber findet. Dies ist nützlich
für die Reinigung von Wasser von diesen Verunreinigungen. Benannt ist
das Bakterium nach dem Oneida-See in New York, wo es 1988 erstmals
isoliert wurde.
Noch besser ist die Tatsache, daß es in seiner Zellmembran elektronenleitende Proteine besitzt, die für die Zellatmung unentbehrlich sind. Um die Fähigkeit der Bakterienzellen zu steigern, im Rahmen ihres Stoffwechsels Energie zu produzieren, entwickelt das Team um Guillermo Carlos Bazan ein synthetisches Molekül namens DSFO+, das die Zellmembranen chemisch verändert, aber dank seines Eisengehalts weiterhin Elektronen leiten kann.
Bei Tests mit zwei mutierten Shewanella-Stämmen zeigt sich, daß DSFO+ nicht nur die natürlichen stromleitenden Proteine vollständig ersetzen kann, sondern deren Aufgabe auch effizienter erfüllt und die Energieproduktion der Mikrobe steigert, indem es die Atmung durch Elektronenlieferung an die Membranoberfläche erleichtert. Und im Gegensatz zu einer gentechnischen Veränderung ist die Wirkung der chemischen nur vorübergehend, denn jedes Mal, wenn sich die Bakterien vermehren, verdünnt sich das DSFO+ und kehrt schließlich in seinen ursprünglichen Zustand zurück.
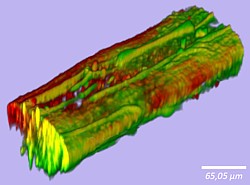
Mikrofaser
Auch die Universität Bayreuth berichtet im April 2017 über die Entwicklung eines künstlichen Biofilms, der die Stromproduktion mikrobieller Brennstoffzellen steigert. Das Material der Forschergruppe um Prof. Ruth Freitag und Prof. Andreas Greiner ist eine Hydrogelmatrix, die aus einem Netzwerk aus winzigen Polymerfasern besteht, in denen sich lebende Bakterien befinden, die metabolisch aktiv sind.
Der neue Biofilm enthält nur Bakterien der Art Shewanella oneidensis, und die elektrische Leistung einer Brennstoffzelle mit diesem Film ist doppelt so hoch, als wenn Bakterien der gleichen Art einen natürlichen Biofilm produzieren. Außerdem verläuft die Stromerzeugung zuverlässig und berechenbar, denn die Dichte der Bakterien ist im künstlichen Biofilm von vornherein festgelegt. Das Biokomposit wird durch das Naß- und Elektrospinnen von Polymerfasern hergestellt, die zusammen einen Vliesstoff bilden.
Auf der konfokalmikroskopischen Aufnahme einer naßgesponnenen Mikrofaser mit Shewanella oneidensis-Bakterien sind die lebenden Bakterien grün dargestellt, die toten rot.
Im März 2018 wird über Experten der Technischen
Universität Clausthal (TUC) berichtet, die eine Methode entwickelt
haben, die den Klärprozeß beschleunigt, indem das Abwasser zukünftig
ohne den Faulprozeß gereinigt wird, und die zugleich Strom erzeugt.
Die Forscher nutzen den Umstand, daß die Bakterien im Abwasser durchgehend
organische Stoffe ableiten und somit Energie freisetzen. Mittels einer bio-elektrochemischen
Brennstoffzelle (BioBZ) wird die bakterielle Aktivität in Elektronen
umgewandelt und auf einer Elektrode gespeichert.
Nach Labortests wird in einer Kläranlage in Goslar im Harz ein Praxistest durchgeführt, der so vielversprechend ist, daß er der Forschergruppe um Uwe Schröder zum Deutschen Nachhaltigkeitspreis 2018 verhilft. Aufgrund der unterschiedlichen Eigenschaften der einzelnen Klärreaktoren kann die Prototyp-Lösung allerdings noch nicht vollständig auf alle Anlagen übertragen werden, weshalb es noch eine Weile dauern wird, bis sich der Ansatz flächendeckend verbreitet.
Im Januar 2020 wird das Clausthaler Verbundprojekt BioBZ mit dem Vorhaben Demo-BioBZ fortgesetzt, das von Prof. Michael Sievers koordiniert und vom Bundesministerium für Bildung und Forschung in den nächsten fünf Jahren mit 5,9 Mio. € unterstützt wird. Dabei soll zusammen mit Partnern der innovative Ansatz optimiert werden, bei dem organische Schmutzstoffe einer Kläranlage mit Hilfe eines Biokatalysators Strom produzieren.
An dem Projekt sind neben der TU Clausthal sechs Partnereinrichtungen beteiligt: die TU Braunschweig, das Karlsruher Institut für Technologie sowie die Firmen Eisenhuth GmbH & Co. KG, Eurawasser Betriebsführungsgesellschaft mbH Goslar sowie Umwelttechnik und Anlagenbau GmbH Plauen.
Gemäß einer im August 2018 veröffentlichten Studie haben
Forscher der Universität Bordeaux, des französischen Centre
national de la recherche scientifique (CNRS), der Universität
Stuttgart und des Max-Planck-Instituts für Intelligente
Systeme (MPI-IS) um Prof. Peer Fischer und
den Postdoktoranden Emmanuel Suraniti eine Lösung für
das generelle Problem gefunden, daß die Energie und Spannung der Elektronen,
die in einer Biobrennstoffzelle erzeugt werden können, eher gering ist.
(Grafik)
Die Spannungen können nicht addiert werden, da sich jede Zelle gezwungenermaßen in derselben Flüssigkeit mit dem gleichen elektrischen Potential befindet – weshalb derzeit Biokraftstoffzellen zumeist nur deutlich weniger als 1 V erzeugen. Hinzu kommt, daß die Gesetze der Thermodynamik ebenfalls die Energie einschränken, die bei enzymatischen Reaktionen freigesetzt werden kann.
Um diese Einschränkungen zu überwinden, werden die bei der Oxidation von Glukose freigesetzten Elektronen zwischengespeichert und ein Teil dieser Energie genutzt, um die Spannung der verbleibenden Elektronen zu erhöhen, wozu keine externe Energie benötigt wird.
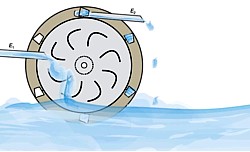
Das Funktionsprinzip beruht darauf, die Energie der Elektronen vorübergehend in einem elektromagnetischen Feld zu speichern. Um dies zu erreichen, wird ein kleiner elektronischer Schaltkreis – angetrieben durch die chemische Reaktion selbst – in die Biobrennstoffzelle integriert, um Strom zu gewinnen und die Spannung zu erhöhen. Das Konzept der Aufwärtsreaktion kann durch ein Wasserrad veranschaulicht werden, bei dem ein kontinuierlicher Wasserstrom von links auf einem Energieniveau E1 ein Schaufelrad dreht, das periodisch eine kleinere Wassermenge auf ein höheres Energieniveau E2 auf der rechten Seite anhebt.
Das Konzept ermöglicht damit, die Oxidation reichlich vorhandener niederenergetischer Moleküle zu nutzen, um daraus Moleküle herzustellen, die (eigentlich) mehr Energie benötigen, um sich zu bilden – z.B. durch die Umwandlung einfacher Biomoleküle in hochenergetische Kraftstoffe. Die im Netz einsehbare Studie trägt den Titel ‚Uphill production of dihydrogen by enzymatic oxidation of glucose without an external energy source‘.
Im September beschreibt ein Team der Ruhr-Universität Bochum (RUB)
um Prof. Wolfgang Schuhmann und Adrian Ruff gemeinsam
mit Kollegen des Max-Planck-Instituts für Chemische Energiekonversion in
Mülheim an der Ruhr und der Universität Lissabon einen
neu entwickelten Mechanismus, um Enzyme als Biokatalysatoren in Brennstoffzellen
vor Sauerstoff zu schützen (‚A fully protected hydrogenase/polymer-based
bioanode for high-performance hydrogen/glucose biofuel cells‘).

Versuchszelle der RUB
Die Enzyme, sogenannte Hydrogenasen, sind ebenso effizient wie Edelmetallkatalysatoren, aber instabil, wenn sie mit Sauerstoff in Kontakt kommen. Daher sind sie bislang nicht für technologische Anwendungen geeignet. Der neue Schutzmechanismus basiert daher auf Sauerstoff verbrauchenden Enzymen, die ihre Energie aus Zucker beziehen.
Bereits in früheren Arbeiten hatte das Team gezeigt, daß sich Hydrogenasen vor Sauerstoff schützen lassen, indem man sie in ein Polymer einbettet. Allerdings verbraucht dieser Mechanismus Elektronen, was die Leistung der Brennstoffzelle senkt. Außerdem wird ein Teil des Katalysators für den Schutz des Enzyms verbraucht.
Um das katalytisch aktive System vom Schutzmechanismus zu entkoppeln, bauen die Wissenschaftler mit Hilfe von zwei Enzymen ein Sauerstoffentfernungssystem um die stromproduzierende Elektrode herum. Hierzu beschichten sie die Elektrode zunächst mit den Hydrogenasen, welche in eine Polymermatrix eingebettet sind, um sie zu fixieren. Darauf setzen sie eine weitere Polymermatrix, die die darunter liegende Katalysatorschicht vollständig umschließt und zwei Enzyme enthält, die Sauerstoff mittels Zucker zu Wasser umsetzen.
Als Resultat wird in der unten liegenden Hydrogenase-haltigen Schicht Wasserstoff oxidiert. Die Elektrode nimmt die dabei frei werdenden Elektronen auf, während die Deckschicht den schädlichen Sauerstoff entfernt. Indem die Gruppe die Bioanoden anschließend mit Biokathoden kombiniert, welche ebenfalls auf der Umsetzung von Glukose basieren, wird eine funktionstüchtige Biobrennstoffzelle geschaffen, die mit Wasserstoff und Glukose als Treibstoff arbeitet.
Die kostengünstige und reichlich vorhandene Biomasse Glukose stellt dabei nicht nur den Brennstoff für das Schutzsystem dar, sondern treibt auch die Biokathode an und generiert so einen Stromfluß in der Zelle, die eine Leerlaufspannung von 1,15 V erzielt. Dies sei der höchste Wert, der bislang bei einer Zelle erreicht wurde, die eine polymerbasierte Bioanode enthält.

Versuchszelle der RUB
Schon im November folgt ein weiterer Bericht der Forschungsgruppe, bei dem es um Gasdiffusionselektroden geht, die gasförmige Ausgangsstoffe für eine chemische Reaktion effizient zur Elektrodenoberfläche mit dem Katalysator transportieren können. Da der Katalysator darin elektronisch direkt an die Elektrodenoberfläche gebunden ist, kann man jedoch nur eine einzige Enzymlage auf der Elektrode aufbringen, was den Stromfluß limitiert.
Nachdem die zuvor entwickelte Polymermatrix auf ebenen Elektroden getestet worden war, wird sie nun auch bei porösen dreidimensionalen Strukturen eingesetzt, wie sie Gasdiffusionselektroden besitzen. Diese Strukturen bieten eine große Oberfläche und ermöglichen so eine hohe Enzymbeladung. Zu klären ist, ob der Sauerstoffschutzschild auch auf diesen Strukturen funktioniert und ob das System dann noch gasdurchlässig ist.
Problematisch für den Herstellungsprozeß ist unter anderem, daß die Elektroden hydrophob, also wasserabweisend, sind, die Enzyme aber hydrophil, also wasserliebend. Die beiden Oberflächen neigen also dazu, sich gegenseitig abzustoßen.
Um stabile Filme mit guter Katalysatorbeladung zu erzielen, wird zunächst eine Adhäsionsschicht auf die Elektrodenoberfläche aufgetropft, auf die im zweiten Schritt die Polymermatrix mit dem Enzym aufbrachten. Hierzu wird eine Polymermatrix mit einer optimalen Balance aus hydrophilen und hydrophoben Eigenschaften synthetisiert. Es erweist sich, daß die so aufgebauten Elektroden immer noch gasdurchlässig sind, und daß die Polymermatrix als Sauerstoffschutzschild auch bei porösen dreidimensionalen Elektroden funktioniert.
Mit dem System erzielten die Wissenschaftler eine Stromdichte von 8 mA/cm2, während frühere Bioanoden mit Polymer und Hydrogenase nur 1 mA/cm2 erreicht hatten. Eine funktionierende Brennstoffzelle mit der beschriebenen Bioanode mit einer Biokathode erreicht eine Leistungsdichte von bis zu 3,6 mW/cm2 und eine Leerlaufspannung von 1,13 V, was knapp unter dem theoretischen Maximum von 1,23 V liegt.
Ebenfalls im September 2018 veröffentlicht ein Team
der University of California in Berkeley die Beschreibung
eines bisher unbekannten Mechanismus des extrazellulären Elektronentransfers (EET).
Die Gruppe um Daniel A. Portnoy hatte das Bakterium Listeria
monocytogenes untersucht, das bei Menschen und Tieren Listeriose
auslösen kann, was zu Bauchschmerzen und Durchfall führt. Außerdem erzeugt
es Strom, indem es einzelne Elektronen, die beim Stoffwechsel übrig bleiben,
in die Umgebung abgibt.
Aufmerksam darauf geworden war Portnoy aufgrund einer Veröffentlichung des kanadischen Labormediziners Harry Deneer, der 1995 ein Enzym auf der Listerien-Oberfläche beschrieben hatte, das oxidierte Eisen-Ionen – d.h. Rost – in weniger oxidiertes Eisen verwandelt, was nur funktionieren kann, wenn die Elektronen durch die Bakterienmembran nach außen geschleust werden. Damals ging Deneer aber das Geld aus, um den Mechanismus weiter aufzuklären: „Sonst hätten wir vielleicht schon in den 90ern gelernt, mit Bakterien Strom zu erzeugen.“
Durch Versuche an Mäusen, die sie mit den Darmbakterien infizieren, findet das Portnoy-Team nun heraus, daß der Mechanismus auch beim Besiedeln eines Körpers hilft, denn die entsprechenden Bakterienkulturen vermehren sich erheblich schneller als mutierte Varianten, die keinen Strom erzeugen können. Als entscheidend für die Fähigkeit, Elektronen durch die Zellwand zu transportieren, erweisen sich dabei acht Gene im Erbgut des Bakteriums.
Varianten dieser Gene finden die Biologen über eine Gendatenbank auch bei Hunderten anderen Bakterienarten, bei denen die Reaktionskette für den Elektronentransport aber recht komplex ist. Bei Listeria monocytogenes wird hingegen ein einfacherer Mechanismus gefunden, bei dem Proteine, Chinon- und Flavinmoleküle die Elektronen durch die Zellwand in die Umgebung bringen. In geeigneter Umgebung gibt jede Bakterienzelle einige 100.000 Elektronen pro Sekunde ab, was eine Stromstärke von 500 µA ergibt.
Listerien sind zudem viel leichter zu kultivieren als andere Bakterien und werden mit Rinderdung gefüttert, der ausreichend Flavine enthält. Dreht man ihnen dann die Sauerstoffzufuhr ab, geben sie ihre Elektronen an die Elektroden weiter.
Im November 2018 berichten die Blogs über eine interessante
Variante: Forscher des Stevens Institute of Technology um Manu
S. Mannoor und Sudeep Joshi haben demnach einen bionischen
Pilz erschaffen, der mit Hilfe von Bakterien und Graphen-Nanobändern
(GNR) Elektrizität erzeugt. Im Versuch erzeugt ein mit einem 3D-Drucker
hergestelltes Geflecht auf dem Pilzhut eines Champignons bei Beleuchtung
einen Strom von 65 nA. Das reicht
zwar nicht aus, um ein Gerät mit Strom zu versorgen, aber es wird angenommen,
daß eine Gruppe von Pilzen eine LED zum leuchten bringen könnte.

Als Mikroorganismen kommen Zyanobakterien zum Einsatz, blaugrüne Algen, die in einer Trägersubstanz gebunden sind und Elektronen an die Leitungsbahnen aus Graphen abgeben. Der Pilz wiederum bietet den Mikroorganismen ein lebensfreundliches Milieu, in welchem sie lange überleben, während sie auf einer Silikonattrappe schon bald sterben.
Der Effekt wird darauf zurückgeführt, daß das Trägergewebe mit der Trägersubstanz der Algen Nährstoffe und Wasser austauscht und außerdem den pH-Wert stabil hält. Pilze sind dafür besonders geeignet, weil ihre Köpfe einerseits porös sind und andererseits komplett aus Pilzfäden bestehen, die Wasser und Nährstoffe von weiter entfernt heranführen. Pflanzen dagegen besitzen isolierende Schichten auf ihren Blättern und eignen sich daher weniger gut als Träger.
Bei ihrer künstlichen ‚bionischen Symbiose‘ erzeugen die Forscher zuerst das Netz von Leitungsbahnen, indem es einen leitenden Kunststoff mit Graphen-Nanobändern mischen und auf den Pilzhut drucken. Anschließend drucken sie eine Mischung aus Alginat und Zyanobakterien in einem Spiralmuster auf den Pilz.
Die Arbeitsgruppe betrachtet ihre neue Quelle photosynthetischer Bioelektrizität allerdings weniger als Beitrag zur Energieversorgung als vielmehr eine experimentelle Demonstration der verwendeten Techniken, um eine „neue Dimensionen für die Weiterentwicklung der bakteriellen Nanobionik zu schaffen“. Trotzdem suchen die Forscher nach Möglichkeiten, die elektrische Leistung des Pilzes zu erhöhen. Ihre einsehbare Studie trägt den Titel ‚Bacterial Nanobionics via 3D Printing‘.
In Verbindung mit den mehrfach erwähnten Geobacter-Bakterien
berichten Forscher der Universität von Virginia, der Universität
von Kalifornien in Irvine und der Universität Yale um
Prof. Nikhil Malvankar im April 2019 über
eine besondere Entdeckung.
Bekannt war, daß die Bakterien tief im Meer oder unter der Erde, wo es keinen Sauerstoff gibt, ‚atmen‘, indem sie winzige leitfähige Proteinfäden – ein Hunderttausendstel so breit wie ein menschliches Haar – in den Boden schleudern, um überschüssige Elektronen aus der Umwandlung von Nährstoffen in Energie zu entsorgen. Bisher hatte man aber noch nicht herausgefunden, woraus diese Nanodrähte bestehen und warum sie leitfähig sind.
Mit Hilfe der hochauflösenden Kryo-Elektronenmikroskopie können die Forscher die atomare Struktur der Nanodrähte sehen und entdecken, daß die Protein-Nanodrähte einen Kern aus metallhaltigen Molekülen haben, die Häme genannt werden. Dies sind Komplexverbindungen mit einem Eisen-Ion als Zentralatom und einem Porphyrin-Molekül als Ligand. Die Hämatome reihen sich aneinander, um einen kontinuierlichen Pfad zu schaffen, auf dem die Elektronen reisen.
Im Mai 2019 veröffentlicht ein Team der Cornell
University um Prof. Buz Barstow und den Doktoranden Farshid
Salimijazi eine Studie mit dem Titel ‚Electrical Energy Storage
With Engineered Biological Systems‘, in welcher sie elektroaktive Mikroben
beschreiben, die (externe) erneuerbare Energie nutzen, um Kohlendioxidmoleküle
aus der Luft aufzuspalten. Die Mikroben können dann aus den Kohlenstoffatomen
Biokraftstoffe wie Isobutanol oder Propanol herstellen, die in einem
Generator verbrannt oder Benzin beigemischt werden. Letztlich handelt
es sich hier um eine Form der Energiespeicherung.
Die Hinzufügung von synthetischen oder nicht-biologischen elektrischen Elementen soll die neue Methode noch produktiver und effizienter machen als die Mikroben allein. Für die Zukunft planen die Forscher, alle möglichen Kombinationen von elektrochemischen und biologischen Komponenten zu testen, um die besten Kombinationen zu finden.
Ein weiterer Bericht vom September 2021 betrifft die Arbeiten des Forschungsteams zur Identifizierung jener Gene beim Bakterium Shewanella oneidensis, die daran beteiligt sind, die Elektronen in die Zelle hinein zu bringen (‚Identification of a pathway for electron uptake in Shewanella oneidensis‘, im Netz einsehbar). Hierzu entwickelt das Team eine Technik, die es ‚Knockout-Sudoku‘ nennt, bei der einzelne Gene ausgeschaltet werden, um deren Funktion zu bestimmen. Auf diese Weise kann eine Gruppe von Genen bestimmt werden, die für den Prozeß der Elektronenaufnahme von zentraler Bedeutung sind.
Die Forscher finden dabei heraus, daß viele Gene, von denen bereits bekannt war, daß sie Elektronen aus der Zelle herausholen, auch an der Aufnahme von Elektronen beteiligt sind. Daneben entdecken sie aber auch eine völlig neue Gruppe von Genen, die noch niemand zuvor gesehen hat und die benötigt werden, um Elektronen in die Zelle zu bringen. Die Gruppe findet zudem heraus, daß der Prozeß der Elektronenaufnahme hocheffizient ist und leicht vergrößert werden kann.
Als nächstes ist geplant, die neu entdeckten Gene in E. coli einzubauen, da dies eines der am besten untersuchten und erforschten Bakterien ist. Andere Wege betreffen die Optimierung des Bakteriums Shewanella oneidensis sowie die Untersuchung anderer metalloxidierender Mikroben. Dem Team zufolge öffnen ektronenbetriebene Bakterien die Tür für die Nutzung erneuerbarer Energien zur Herstellung von Biokraftstoffen, Lebensmitteln, Chemikalien und zur Kohlenstoffbindung.
Im Mai 2019 stellt ein Team der East China
Normal University (ECNU) in Shanghai sowie der Chinese
Research Academy of Environmental Sciences in Peking um Ming
Hu einen neuen Stromgenerator vor, zu dem es sich durch spezielle
marine Mikroorganismen hat inspirieren lassen, die ihre Zellatmung
je nach benötigtem Leistungs-Output zwischen einem aeroben und einem
anaeroben Modus wechseln, indem sie verschiedene Stoffe als Elektronenakzeptoren
verwenden.
Das Erfolgsgeheimnis ist eine Kathode aus Berliner Blau, einem lichtechten, tiefblauen, anorganischen Pigment, das als luft- und wasserstabiler Feststoff vorliegt. Es bildet eine offene Gerüst-Struktur mit Cyanid-Ionen als ‚Verstrebungen‘ und Eisenionen als ‚Knotenpunkten‘, die leicht Elektronen aufnehmen und abgeben können. Mit einer Metallanode kombiniert läßt sich damit Strom aus Meerwasser generieren.
Ist die abgerufene Leistung gering, werden die in die Kathode einfließenden Elektronen sofort auf gelösten Sauerstoff übertragen. Da gelöster Sauerstoff im Meer unerschöpflich ist, kann die Energieversorgung bei niedrigem Stromfluß theoretisch ewig laufen. Die Konzentration des Sauerstoffs jedoch ist gering, weshalb es nicht genug Sauerstoff an der Kathode gibt, um alle ankommenden Elektronen sofort aufzunehmen, wenn die abgerufene Leistung und damit die Stromstärke stark erhöht werden.
In diesem Fall speichert das Berliner Blau diese Elektronen, indem Eisenionen vom dreifach in den zweifach positiv geladenen Zustand wechseln. Für den Ladungsausgleich lagern sich positiv geladene Natriumionen in das Gerüst ein. Da diese in hoher Konzentration in Meerwasser vorhanden sind, können viele Natriumionen und damit auch viele Elektronen in kurzer Zeit aufgenommen werden.Nimmt der Stromverbrauch wieder ab, werden die Elektronen wie zuvor auf den Sauerstoff übertragen, der das Gerüst zudem wieder regeneriert: Fe2+ wird wieder zu Fe3+, und die Natriumionen treten aus.
Das neue System erweist sich in korrosivem Meerwasser als sehr stabil und übersteht eine Vielzahl an Moduswechseln. Im Hochenergie-Modus läuft es kontinuierlich über vier Tage, ohne an Leistung zu verlieren, während es im Hochleistungs-Modus 39 Leuchtdioden versorgen und einen Propeller antreiben kann.
(Grafik)
Im gleichen Monat berichtet ein Team der University of New South
Wales (UNSW) um Kang Liang über ihre Entwicklung
von Mikromotoren, die nicht mehr auf externe Antriebskräfte
und Manipulationen angewiesen sind, um zu einem bestimmten Ort zu navigieren.
Stattdessen nutzen sie die Variationen der biologischen Umgebung, um
sich selbst zu steuern (‚Biocatalytic self-propelled submarine-like metal-organic
framework microparticles with pH-triggered buoyancy control for directional
vertical motion‘).
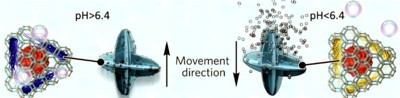
Sich aus eigener Kraft zu bewegen und z.B. Medikamente ortsgenau in den Körper zu bringen, geschieht mit einem System, das dem Auf- und Abtauchen von U-Booten ähnelt, die den Ballast mit Wasser füllen, um nach unten zu sinken, oder mit Luft, um nach oben zu schweben. Die Mikro-U-Boote, die aus metallorganischen Gerüsten (MOFs) bestehen, d.h. zerkleinerten Materialien, die eine extrem große Oberfläche haben und große Mengen an Nutzlast auf relativ kleinem Raum aufnehmen können, tun dasselbe, indem sie entweder Gasblasen sammeln oder freisetzen.
Die Blasen werden durch ein bioaktives Enzym erzeugt, bevor sie sich in den Poren der MOFs sammeln. Die Maschine selbst reagiert auf unterschiedliche pH-Werte im Körper – in saurem Milieu halten die MOFs die Gasblasen fest und helfen ihnen, nach oben zu schweben. Steigt der pH-Wert an, werden diese Blasen freigesetzt und das U-Boot sinkt wieder. Dieser Mechanismus ermöglicht eine 3D-Bewegung, um die Mikro-U-Boote zu den säurehaltigeren Krebszellen zu lenken, und die Medikamente präziser zu verabreichen.
Im September 2019 stellen Forscher des Instituts für
Mikrobiologie der Chinesischen Akademie der Wissenschaften ein
neuartiges Biophotovoltaik-System (BPV) vor, das auf
einem künstlichen mikrobiellen Verbund basiert. Die bisher gemeldeten
Leistungsdichten von BPV-Systemen sind gering, da photosynthetische Mikroorganismen
nur über eine geringe Fähigkeit verfügen, Elektronen außerhalb der Zellen
zu übertragen.
Um dieses Problem zu umgehen, schaffen die Forscher einem mikrobiellen Verbund, der sich aus photosynthetischen Cyanobakterien und dem exoelektrogenen Bakterium Shewanella zusammensetzt, wobei letzteres von Natur aus eine starke exoelektrogene Aktivität besitzt. Als Energieträger für den gerichteten Energietransfer zwischen den Cyanobakterien und den Shewanella wird D-Lactat ausgewählt.
In diesem Verbund fangen die Cyanobakterien Sonnenenergie ein und binden CO2, um D-Lactat zu synthetisieren, während die Shewanella durch Oxidation von D-Lactat Strom erzeugen, wodurch ein begrenzter Elektronenfluß von Photonen zu D-Lactat und dann zu Elektrizität entsteht. Durch genetische Manipulation sowie Optimierung des Wachstumsmediums und des Geräts sind die beiden sehr unterschiedlichen Mikroorganismen in der Lage, effektiv zusammenzuarbeiten.
Das neue BPV-System erzeugt eine durchschnittlichen Leistungsdichte von 135 mW/m2 und eine maximale von 150 mW/m2 und kann in einem räumlich-zeitlich getrennten Aufbau mit Mediennachschub mehr als 40 Tage lang stabil arbeiten. Dem Team zufolge sei dies die längste Lebensdauer und die höchste Leistungsabgabe pro Gerät, die bisher von einem BPV-System berichtet wurde.
Die Entwicklungen des Teams um Jun Yao an der University
of Massachusetts Amherst, über die im Februar 2020 berichtet
wird, habe ich bereits im Kapitelteil zur Luftfeuchtigkeit dokumentiert
(s.d.).
Im April 2020 verkünden Forscher am Karlsruher
Institut für Technologie (KIT) um Christof Niemeyer die
Entwicklung einer Biohybrid-Batterie, die gleich zwei
entscheidende Aufgaben erfüllt. Konkret handelt es sich um ein poröses Hydrogel aus
Kohlenstoff-Nanoröhrchen und Siliziumdioxid-Nanopartikeln, die Strom
leiten und durch miteinander verwobene DNA-Stränge zusammengehalten werden.
Dadurch entsteht eine leitfähige Matrix, auf der sich die exoelektrogenen Shewanella
oneidensis Bakterien ansiedeln.
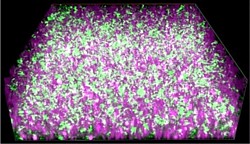
des KIT
Die neu entwickelte Struktur sorgt zum einen dafür, daß die Elektronen gezielt zur Elektrode geleitet werden, um den Stromfluß effektiv steuern und nutzen zu können, was bislang mit Schwierigkeiten verbunden war. Gleichzeitig hat sie die Aufgabe, möglichst viele Bakterien zu verbinden. Und tatsächlich siedeln sich immer mehr Bakterien auf der Matrix an und dringen tief in die Poren des Hydrogels ein, was zu einem steigenden Stromfluß führt.
Mit Hilfe eins Enzyms, das die DNA-Stränge durchtrennt und das Material zum Kollabieren bringt, können die Forscher den Prozeß auch wieder unterbrechen. Am wichtigsten ist aber, daß das System über mehrere Tage stabil bleibt und eine konstante elektrochemische Aktivität zeigt. Die Ergebnisse deuten zudem darauf hin, daß mögliche Anwendungen solcher Materialien über mikrobielle Biosensoren, Bioreaktoren und Brennstoffzellensysteme hinausgehen könnten.
Auf der Abbildung ist das Nanokompositmaterial (violett) zu sehen, das die von den exoelektrogenen Bakterien (grün) freigesetzten Elektronen zur Stromerzeugung leitet. Die Studie trägt den Titel ‚Cultivation of Exoelectrogenic Bacteria in Conductive DNA Nanocomposite Hydrogels Yields a Programmable Biohybrid Materials System‘.
Berichten zufolge haben Wissenschaftler der Universität Linköping um Gábor
Méhes um Eleni Stavrinidou einen organischen
elektrochemischen Transistor entwickelt, mit dem sie
den extrazellulären Elektronentransfer messen und
detailliert untersuchen können, bei dem Bakterien Elektronen abgeben.
Hierfür setzen sie eine Kombination aus Mikroelektronik, Elektrochemie
und Mikrobiologie ein. Die im Juni 2020 veröffentlichte
und im Netz einsehbare Studie trägt den Titel ‚Organic microbial electrochemical
transistor monitoring extracellular electron transfer‘.
Bei dem Transistor wird Shewanella oneidensis auf einer der Mikroelektroden mit einer Oberfläche von nur einem Viertel Quadratmillimeter angebracht. Die Verstärkung des Signals im Transistor ermöglicht es, im Detail zu untersuchen, was passiert, wenn dem System verschiedene Substanzen zugeführt werden, z.B. Laktat. Es gelingt dabei, sehr kleine Unterschiede im extrazellulären Elektronentransfer nachzuweisen, sehr kurze Reaktionszeiten zu erreichen und innerhalb von zehn Minuten ein stabiles Signal zu erhalten.
Im Mai 2021 veröffentlichen Prof. Zhen ‚Jason‘
He und seine Kollegen der Washington University in
St. Louis einen Bericht über ihre Ergebnisse bei Versuchen im Labormaßstab
mit einem System, das Abwasser filtert und gleichzeitig Strom erzeugt.
Hierzu war das Filtersystem in die Anodenelektrode einer
typischen mikrobiellen Brennstoffzelle integriert worden (‚Enhancing
the performance of a microbial electrochemical system with carbon-based
dynamic membrane as both anode electrode and filtration media‘).
Das System besitzt eine durchlässige Anode in Form einer dynamischen Membran, die aus leitfähigem Kohlenstoffgewebe besteht. Gemeinsam filtern die Bakterien und die Membran 80 – 90 % der organischen Stoffe heraus, so daß das Wasser sauber genug ist, um in die Natur entlassen oder für die Verwendung als Brauchwasser weiter aufbereitet zu werden. Das Hauptziel des System ist jedoch nicht die Stromerzeugung, sondern die Abwasserreinigung und Nährstoffrückgewinnung.
Über einen quasi gegensätzlichen Einsatz von Bakterien wird im November 2021 berichtet.
Demnach arbeiten Miriam Rosenbaum et al. am Leibniz-Institut
für Naturstoff-Forschung in Jena daran, den Strom aus Wind-
und/oder Solarfarmen zu nutzen, um mittels der elektrobiochemischen Synthese
(o. Elektrobiosynthese) ohne Umwege wertvolle Chemikalien aus reinem
Strom und CO2 zu gewinnen. Ein interessantes Gebiet – das
aber über das Micro Energy Harvesting hinausgeht und daher hier nicht
weiter behandelt wird.
Daß das Thema der mikrobiellen Brennstoffzellen und
der mikrobiellen Elektrosynthese zunehmend an Interesse
gewinnt, belegt ein Bericht des Magazins MIT Technology Review vom
November 2021, dem zufolge es in diesem Jahr schon über
4.600 Publikationen zu diesem Thema gegeben habe. Es ist klar, daß eine
Gesamtübersicht damit immer schwieriger wird. Trotzdem möchte ich hier
noch einige Veröffentlichungen der nachfolgenden Jahre dokumentieren.

mit Cyanobakterien
So beispielsweise die Publikation vom März 2022 von
Forschern der University of Cambridge um die chinesisch-australische
Chemikerin Jenny Z. Zhang, die mittels Cyanobakterien Sonnenlicht
in Strom umwandeln. Hierfür werden per 3D-Druck mit unzählige eng beieinanderstehende
Nanotürmchen gebaut, in denen sich die Bakterien wohlfühlen.
Dem Team gelingt es, einen Teil der Elektronen, die die Bakterien erzeugen, abzuzweigen und als elektrischen Strom zu nutzen. Das ist auch anderen Forschern schon gelungen, doch die Ausbeute bei den Mikroorganismen in den Nanotürmchen ist um eine ganze Größenordnung höher. Laut Zhang dachten die meisten Wissenschaftler bislang, daß der Engpaß in Bezug darauf, wie viel Energie man tatsächlich aus photosynthetischen Systemen extrahieren kann, auf der biologischen Seite liegt, d.h. in den Bakterien.
Tatsächlich erweist sich, daß der Engpaß auf der materiellen Seite liegt, denn um zu wachsen und Elektronen zu erzeugen, brauchen die Cyanobakterien viel Sonnenlicht. Und sie müssen an Elektroden befestigt werden, damit die Energie, die sie durch Photosynthese produzieren, extrahiert werden kann. Die Nanotürmchen, zwischen denen die Bakterien leben, bestehen aus einem leitfähigen Metalloxid und fungieren als derartige Elektroden – wobei sie hervorragende Lichteigenschaften haben, wie „eine Hochhauswohnung mit vielen Fenstern.“
Die im Juli 2022 veröffentlichte und einsehbare Studie trägt den Titel ‚3D-printed hierarchical pillar array electrodes for high performance semi-artificial photosynthesis’.

Uni Cambridge
Interessanterweise erscheint bereits im Mai eine weitere Publikation
der Universität Cambridge mit dem Ergebnis eines Langzeittestes. Wissenschaftler
um Paolo Bombelli haben demnach gemeinsam mit dem
Unternehmen ARM untersucht, ob man einen Computer mit Licht und Wasser
mit Energie versorgen kann. Hierzu hatten sie eine biologische Energiezelle
mit dem Volumen einer konventionellen AA-Batterie entwickelt, in der Synechocystis leben,
eine Gattung der Cyanobakterien (Blaualgen) .
Die Energiezelle besitzt zwei Aluminiumelektroden und erzeugt eine niedrige elektrische Spannung, die einen ARM-Cortex-M0+-Prozessor mit Strom versorgt, einen äußerst sparsamen 32-Bit-Prozessor, der in Industrie-Steuerungseinheiten vorkommt. Und im Gegensatz zu der Erwartung, die Batterie würde nach wenigen Tagen oder Wochen aufgeben, liefert sie nach mehr als sechs Monaten noch immer pausenlos Strom. Weitere Vorteile: Temperaturschwankungen mindern ihre Leistung nicht, und nachts zehrt sie von der tagsüber erzeugten Nahrung. Wie lange das noch geht, ist bislang nicht absehbar.
An der Herausforderung, Methan aus natürlichen Quellen
- vor allem aus Feuchtgebieten - ohne Verbrennen in elektrischen Strom
umzuwandeln, arbeiten Mikrobiologen der niederländischen Radboud
Universiteit um
die Dozentin Cornelia Welte. Das gelingt mit dem Bakterium Candidatus
Methanoperedens, das in der Natur hauptsächlich dort vorkommt, wo
Nitratdünger Wasser verseucht, da zum Nitratabbau Methan benötigt wird
– das übrigens 25 Mal klimaschädlicher ist als CO2.
Weltes Kollegen hatten den neuen Prozeß bereits vor einiger Zeit mit Anammox-Bakterien demonstriert, die Stickstoffdünger (Nitrat) knacken, wenn sie mit Ammonium versorgt werden. Mit dem Mikroorganismus Candidatus Methanoperedens wiederum gelang es im Labor, 31 % des angebotenen Methans in elektrische Energie umzuwandeln. Die Forscher sind sich aber sicher, daß sie den Wirkungsgrad noch steigern können.
Möglicherweise ist das Verfahren auch geeignet, um den Wirkungsgrad von Biogasanlagen zu verbessern, die das Produkt Methan verbrennen, um Strom und/oder Wärme zu erzeugen – wobei weniger als die Hälfte des Biogases in Strom umgewandelt wird, was auch die maximal erreichbare Menge ist. Ebenso geeignet sind Kläranlagen in nitratbelasteten Regionen, in deren Faultürmen Methan erzeugt wird.

auf Chip
Ein Forschungsteam der Technischen Universität München (TUM) und des Massachusetts Institute of Technology (MIT) um Professorin Jennifer L. M. Rupp und Philipp Simons stellt im Mai 2022 eine Glucose-Brennstoffzelle vor, die den körpereigenen Zucker nutzt, um Strom für medizinische Implantate zu liefern. Im Gegensatz zu früheren Ansätzen mit hitzeempfindlichen Polymeren als Elektrolytschicht, die sich deshalb nur schlecht sterilisieren ließen, nutzt die neue Zelle einen harten und bioverträglichen keramischen Elektrolyt (‚A Ceramic-Electrolyte Glucose Fuel Cell for Implantable Electronics‘).
Insgesamt ist die Anordnung nur 400 nm dick und besteht aus zwei Elektroden aus Platin, zwischen denen eine dünne Schicht aus keramischen Cerdioxid (CeO2) eingebracht ist.
Für die Stromerzeugung nutzt die Brennstoffzelle dann die in den Körperflüssigkeiten vorhandene Glucose, die an der Anode in Glukonsäure umgewandelt wird, wobei ein Paar Protonen sowie ein Paar Elektronen freigesetzt werden. Die Protonen werden vom Elektrolyt durch die Brennstoffzelle zur Kathode geleitet, wo sie sich mit Luft zu Wassermolekülen verbinden, während die freigewordenen Elektronen in einen externen Stromkreis abgeleitet werden und zur Stromversorgung des elektronischen Implantats dienen.
In ersten Versuchen werden Testsysteme mit insgesamt 150 Brennstoffzell-Einheiten verwendet, die auf fünf Silikonchips verteilt sind. Wenn diese Wafer von einer Glukoselösung überflossen werden, erreichen die kleinen Dünnschicht-Brennstoffzellen im Schnitt eine Spannung von etwa 35 mV bei einer Energiedichte von etwa 12 µW/cm2. Die maximale Energiedichte wird mit 43 µW/cm2 angegeben.
(Grafik)
Im März 2023 sind es australische Wissenschaftler der Monash
Universität um Prof. Chris Greening und Rhys
Grinter, die in ihrer Studie über die Entdeckung eines Enzyms berichten,
das sie im Laufe von fünf Jahren aus Mycobacterium smegmatis isoliert
haben und das die geringen Mengen an Wasserstoff in
der Atmosphäre nutzt, um elektrischen Strom zu erzeugen. Es kann also
buchstäblich Strom aus der Luft produzieren (‚Structural basis for bacterial
energy extraction from atmospheric hydrogen‘, im Netz einsehbar).
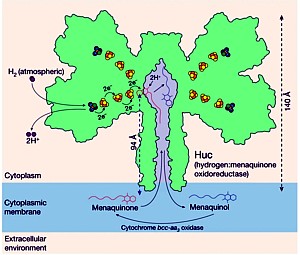
Obwohl Wasserstoff nur 0,00005 % (~ 500 ppb) der Atmosphäre ausmacht, ist das wasserstoffkatalysierende Enzym, das von dem Team Huc genannt wird, aufgrund seiner molekularen Struktur in der Lage, die Wasserstoffmoleküle problemlos und außerordentlich effizient aufzuspalten, um eine Elektronentransportkette zu bilden, die einen ‚elektrischen Schaltkreis‘ in der Zelle erzeugt. Huc ist damit wie eine Batterie, der nie der Saft ausgeht – solange sich auch nur eine winzige Menge an Wasserstoff in der Luft befindet.
Zudem erweist sich das Enzym als erstaunlich stabil. Es ist möglich, es einzufrieren oder auf 80°C zu erhitzen, ohne daß es seine Fähigkeit verliert, Energie zu erzeugen. Dies zeigt, daß dieses Enzym Bakterien hilft, in den extremsten Umgebungen wie in antarktischen Böden, Vulkankratern und in der Tiefsee zu überleben. Ein kommerzieller Erfolg liegt aber noch in der Ferne, denn die Wissenschaftler haben bisher nur eine geringe Menge an Ladung aus einem ebenso geringen Vorrat des Enzyms erzeugt.
Weiter mit den Flüssigkeiten...