Buch der Synergie

| Blättern |
 TEIL C
TEIL C
MICRO ENERGY HARVESTING
Bakterielle
Systeme (III)
Doch auch bei den wissenschaftlichen und kommerziellen Entwicklungen
geht es kräftig weiter:
(Grafik)
Zu den ersten, die sich mit Mikroben zur Stromgewinnung beschäftigen,
gehört Prof. Bruce E. Logan von der Pennsylvania
State University (PSU). Bereits im März 2004 kann
er einen Stromgenerator zeigen, der seine Energie ausschließlich aus
Abwasser bezieht. Da das Gerät dabei auch noch schädliche organische
Materie zerlegt, macht es gleichzeitig den Job einer Kläranlage. Es
handelt sich um die erste MFC, die zur Stromerzeugung speziell menschliche
Abfälle verarbeiten soll – frühere Entwürfe liefen nur mit Glukose-Lösungen
(s.u. Flüssigkeiten).
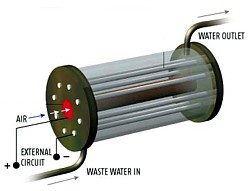
Die MFC, die mit einer Unterstützung der National Science Foundation (NSF) in Höhe von 87.000 $ entwickelt wurde, besteht aus einer abgedichteten, 15 cm langen Dose mit knapp 6,5 cm Durchmesser. Im Inneren befinden sich ein zentraler Kathodenstab, der von einer Protonenaustauschmembran (PEM) umgeben ist, die nur für Protonen durchlässig ist, sowie acht um die Kathode herum angeordnete Graphitanoden.

Die Bakterien gruppieren sich um die Anoden und zersetzen die organischen Abfälle, die hineingepumpt werden, wobei Elektronen und Protonen freigesetzt werden. Ohne Sauerstoff, der die Elektronen aufnehmen würde, werden diese von den Enzymen der Bakterien an die Anoden übergeben, während die Protonen – veranlaßt durch polarisierte Moleküle auf der PEM – zur zentralen Kathode wandern, wo sie sich mit Sauerstoff aus der Luft zu Wasser verbinden.
Es ist diese Übertragung von Elektronen an den Elektroden, welche die Spannung zwischen diesen aufbaut, so daß die Zelle einen externen Schaltkreis anzutreiben vermag. Logan berichtet, daß die Brennstoffzelle bis zu 78 % des organischen Materials aus dem Wasser entfernt und dabei eine Leistung von 10 - 50 mW pro Quadratmeter Elektrodenoberfläche erzeugt. Später produziert die Zelle sogar bis zu 200 mW/m2, genug, um eine kleine Glühbirne mit Strom zu versorgen.
Im weiteren Verlauf scheint Logan von der Ein-Kammer-Konstruktion aber wieder abzukommen. So ist im April 2009 zu erfahren, daß er sich inzwischen mit einzelligen Mikroorganismen namens Archaeen (o. Archaebakterien) beschäftigt, die durch kleine Stromstöße dazu angehalten werden, CO2 aus der Luft aufzunehmen und in Methan umzuwandeln, welches sie dann in Form winziger ,Fürze’ wieder freigegeben. Besonders bemerkenswert ist dabei die hohe Effizienz der Methanobacterium palustre Mikroben von etwa 80 % bei der Umwandlung von Strom zu Methan.

der PSU
Die Elektromethanogenese, bei der die methanogenen Archaeen Kohlendioxid zu Methan reduzieren, geschieht bei einem festgelegten Potential von weniger als - 0,7 V (gegen Ag/AgCl) in einem elektrochemischen Zweikammer-Reaktor, der eine abiotische Anode und eine Biokathode enthält, jedoch keine Edelmetallkatalysatoren. Der Prozeß benötigt nur sehr wenig Strom, sodaß er auch durch Photovoltaik-Energie angetrieben werden könnte.
Mit einem Dreikammer-Reaktor gelingt es zudem, aus Brackwasser oder Meerwasser bis zu 90 % des Salzes zu entfernen – und dies ohne den Verbrauch von Strom, sondern während dessen Erzeugung.
Die mit Unterstützung der NSF gemachte Innovation wird 2009 zum Patent angemeldet (US-Nr. 20090317882), wobei als Erfinder neben Prof. Logan auch noch Shaoan Cheng genannt wird. Eine ähnliche Anmeldung stammt aus dem Jahr 2011 (US-Nr. 20110281333). Hier werden Prof. Paul W. Brown und Wendy E. Brown als Miterfinder benannt.
Im April 2012 folgt die Meldung, daß die innovative Technologie nun in die Praxis umgesetzt werden soll, indem gemeinsam mit Kollegen der Stanford University ein CO2-zu-Methan-Bioreaktor konzipiert wird. Hierfür wird an der Gestaltung fortschrittlicher Kathoden-Technologien gearbeitet, die das Wachstum von Methanbakterien fördern und die Methanproduktion maximieren. Zudem werden auch neue Materialien für die Elektroden untersucht, einschließlich eines Kohlenstoff-Gittergewebes, das den Bedarf an Platin und anderen Edelmetallkatalysatoren obsolet machen könnte.
Forscher der Oregon
State University (OSU)
unter der Leitung von Prof. Hong Liu entwickeln ihrerseits 2007 eine
neue MFC mit Luftkathode, die 10 Mal mehr Energie produziert als dies
bisher möglich war. Dem Team gelingt es, 1.500 W/m3 Reaktorvolumen
zu erzeugen.

Über weitere Schritte wird im Juli 2010 berichtet, als die Ingenieure der OSU feststellen, daß sich die Stromproduktion aus Abwasser durch Beschichten der MFC-Graphitanoden mit einer Nanopartikel-Goldschicht über 20 Mal erhöhen läßt. Auch die Beschichtung mit Palladium erzeugt eine Erhöhung, die aber nicht annähernd so hoch ist. Die Forscher glauben, daß auch viel billigere Nanopartikel-Beschichtungen mit Eisen eine ähnlich starke Zunahmen bewirken wie bei Gold, zumindest für einige Arten von Bakterien.
Im Juli 2012 folgt die Meldung über einen weiteren Durchbruch: Mithilfe eines veränderten Anoden-Kathoden-Abstands, effektiverer Mikroben sowie neuer Trennmaterialien liefert die MFC jetzt mehr als 2 kW Leistung pro Kubikmeter flüssigen Materials, was laut OSU bis zu 100 Mal mehr ist, als bisher mit mikrobiellen Brennstoffzellen erreicht wurde. Nun werden Geldgeber und Partner für ein Pilotprojekt gesucht.
Die 2007 von Eytan Levy und Ronen
Shechter gegründete
israelische Biotechnikfirma Emefcy
Ltd. (o. Emefcy Group Ltd.) mit Sitz in Caesarea (o. Kaisarya)
entwickelt einen neuartigen Prozeß, der Wasserwerken dabei helfen
soll, in ihren Kläranlagen deutlich weniger Energie zu verbrauchen.
Das Megawatter genannte
Verfahren verwendet eine herkömmliche MFC-Technologie, die zu einem
sogenannten Electrogenic
Bioreaktor ausgebaut wird, der auch unter dem Namen Membrane-Aerated
Biofilm Reactor (MABR) bekannt wird.
Ein solcher Reaktor besteht aus zwei Bereichen: In einem befindet viel Abwasser, aber keine Umgebungsluft, im anderen dafür nur Luft und kein Abwasser. Beide Bereiche sind durch eine Membranwand aus Polyethylen-Kunststoff getrennt – aber auch durch eine elektrisch leitende Oberfläche miteinander verbunden, auf der die Bakterien wachsen.
Während die Mikroorganismen – in erster Linie Shewanella oneidensis und Geobacter sulfurreducens – die Nährstoffe im Abwasser verarbeiten, erzeugen sie Elektronen, die zum Sauerstoff in der Luft drängen und dabei über Elektroden abgeführt werden. Um den Prozeß zu erleichtern, entwickelt Emefcy ein Nanodrahtmaterial, das sich auf der Oberfläche der Bakterien ansiedelt, die somit selbst leitfähig werden.

in Maayan Zvi
Die Firma will nun zeigen, daß die Idee auch kommerziell umsetzbar ist. Durch eine 2011 durchgeführte Finanzierungsrunde, bei der die Risikokapitalfirma Energy Technology Ventures (ETV) einsteigt, die dem Elektrokonzern GE und den Energieriesen NRG Energy und ConocoPhillips gehört, kann Emefcy die Hochskalierung des Verfahrens abschließen. Das einzelne Modul, das etwa der Größe von einem Kubikmeter hat, soll pro Tag bis zu 3 m3 Abwasser behandeln können, in Abhängigkeit von der vorhandenen Menge an organischem Material. Über die dabei erwartete Strommenge ist nichts zu erfahren.
In Israel wird in Maayan Zvi eine Demonstrationsanlage gebaut, die Anfang 2013 auf 16 Module erweitert werden soll. Details über die tatsächliche Leistung oder Wirtschaftlichkeit dieser Module werden aber nicht herausgerückt. Die Firma hofft, daß das skalierbare System kommerziell zu einem Preis von 4.000 - 5.000 $ pro Modul angeboten werden kann. Ich dokumentiere die weitere Entwicklung, obwohl sie über die Dimension des MEH hinausgeht.
In der Brennstoffzellen-Industrie besteht zudem große Skepsis gegenüber der Behauptung des Unternehmens, daß sein System auch im kommerziellen Maßstab funktioniert. Dazu sei der Unterschied zwischen einem Demo-System mit künstlich kontaminiertem Wasser für Labortests und einer professionellen Anlage der realen Welt mit Tausenden Tonnen Abwasser, deren Zusammensetzung sich ständig ändert, viel zu groß. Zudem wird davon ausgegangen, daß 80 % der Energie, die von den Mikroben erzeugt wird, während des Verfahrens verloren geht, da die Elektronen nicht die Elektroden erreichen.
Zhen He, ein Forscher an mikrobiellen Brennstoffzellen an der University of Wisconsin-Milwaukee, weist in diesem Zusammenhang darauf hin, daß sich von den fast 4.000 Papieren, die bislang über MFCs veröffentlicht wurden, weniger als 2 % mit der Verarbeitung von Wassermengen größer als einem Liter befassen. Dessen ungeachtet wird die Emefcy auf dem CleanEquity-Forum in Monaco im März 2015 zum Gewinner der Auszeichnung für Spitzenleistungen im Bereich der Entwicklung von Umwelttechnologien gekürt – worauf die Firma sofort eine weitere Finanzierungsrunde ausruft.
Im Dezember 2015 geht die Emefcy, die bislang insgesamt 35 Mio. $ von Investoren aus China, Singapur, Hongkong, Australien, den Vereinigten Staaten und Israel erhalten hat, an die australische Börse. Die Firma hat derweil Vereinbarungen mit chinesischen Unternehmen unterzeichnet, die Ausschreibungen für den Bau von Abwasseranlagen in mehreren Provinzen gewonnen haben, um diesen Unternehmen Kernkomponenten sowie Beratungen zu bieten. Und auch der erste kommerzielle Vertrag im Wert von rund 380.000 $ für die kommunale Abwasserreinigung im Moschav HaYogev, Israel, wird unterzeichnet.

in der Karibik
Bis Juli 2016 sammelt die Emefcy 23,6 Mio. A$ Eigenkapital – und hat eigenen Angaben zufolge weltweit 44 Projekte in Arbeit. Im August geht die Anlage in HaYogev in Betrieb, und im Oktober wird die Unterzeichnung einer Vertriebs- und Implementierungspartnerschaft mit der Beijing Sinorichen Environmental Protection Corp. Ltd. bekannt gegeben, die auf Beratungs- und Ingenieurdienstleistungen im Bereich der Abwasserbehandlung in der Provinz Peking und Nordchina spezialisiert ist. Im Bezirk Miyun soll nun ein Demonstrationsprojekt entstehen.
Im November wird die Installation einer MABR-Kläranlage in der Region Bordeaux von St. Thomas auf den US-Jungferninseln in der Karibik abgeschlossen, die die Abwässer von rund 200 Haushalten behandelt und dabei nur 10 % des Stroms herkömmlicher biologischer Kläranlagen verbraucht – da statt energiefressenden Kompressoren wasserdichte Membranen eingesetzt werden, die die Diffusion von Sauerstoff aus der Atmosphäre in das Abwasser ermöglichen. Mit dem sich noch immer im der Entwicklung befindlichen elektrogenen Bioreaktor (EBR) soll sogar Strom erzeugt werden.
Darüber hinaus wird derzeit eine Anlage im Ayder-Krankenhaus der Makelle-Universität in Äthiopien gebaut.
Im Mai 2017 erwirbt die Emefcy für einen ungenannten Betrag das Wasser- und Abwasser-Unternehmen RWL Water LLC mit Sitzen in New York und Lima – wobei im Zuge der Fusion die Fluence Corp. Ltd. (früher: Savcor Group Ltd.) entsteht, die alle Segmente der Wasser-Wertschöpfungskette abdecken soll. Von der Emefcy ist danach nichts mehr zu hören.
Zahnräder
Wie sich schwimmende Mikroorganismen einsetzen lassen, um winzige
Zahnräder anzutreiben, berichten im Dezember 2009 Wissenschaftler des
Argonne National Laboratory in Idaho Falls, die dabei mit ihren Kollegen
der Northwestern University zusammenarbeiten.
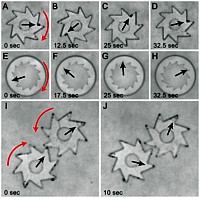
Das Team um Projektleiter Igor Aronson bringt Bakterien der Gattung Bacillus subtilis dazu, im Kreis zu schwimmen und durch ihre Schwimmbewegungen mikroskopische kleine Zahnräder in Rotation zu versetzten. Die Zahnräder haben einen Durchmesser von 380 µm und sind um ein Millionenfaches schwerer als das einzelne Bakterium. Um die Räder in Bewegung zu setzen, bedarf es daher entsprechend großer Gruppen der Mikroorganismen.
Nachdem die Bakterien zunächst ziellos in der Lösung umher schwimmen, stoßen sie irgendwann mit den Zähnen der Rädchen zusammen und beginnen, diese zu drehen. Befinden sich in der Lösung mehrere Zahnräder, deren Zähne ineinandergreifen, werden auch dieses Getriebe von den Bakterien in Bewegung versetzt.
Über den Gehalt von Sauerstoff und Stickstoff in der Flüssigkeit gelingt es zudem, die Geschwindigkeit des Biomotors zu regulieren oder ihn anzuhalten. Die Bakterien bewegen sich umso schneller, je höher der Sauerstoffgehalt ist. Wird hingegen Stickstoff in die Lösung geleitet, verlangsamt sich die Bewegung, bis sie schließlich zum Stillstand kommt, wenn kein Sauerstoff mehr da ist.
Damit der Versuch funktioniert, erweisen sich zwei Bedingungen als entscheidend: die Zähne der Zahnräder dürfen die keine symmetrische Form haben, sondern ihre Kanten müssen verschieden lang sein – und die Konzentration der Bakterien in der Lösung muß hoch genug sein, damit sich diese zu einer kollektiven Schwimmbewegung zusammentun.
Im Februar 2010 beweist ein Forscherteam um Lars
Peter Nielsen von der Universität Aarhus in
Dänemark, daß bestimmte (nicht benannte) Bakterien eigene Ranken oder Nanodrähte wachsen
lassen, sodaß man bald in der Lage sein könnte, eine riesige lebendige
Batterie aus Bakterien zu bilden, die in Salzwasser gedeihen. Sobald
es gelingt, den Mechanismus vollständig verstehen, könnte diese Batterien
beispielsweise verwendet werden, um saubere Energie für Überwachungsbojen
in den Ozeanen zu liefern.
Grundsätzlich werden Elektronen in Bakterienkolonien erzeugt, wenn organische Stoffe und Schwefelwasserstoff im Sediment an die Oberfläche transportiert werden, wo sie mit Sauerstoff reagieren. Tests zeigen allerdings, daß es eine viel engere Verbindung zwischen den Schichten von Bakterien gibt, als nur eine einfache molekulare Diffusion oder herkömmliche chemische Reaktionen.
Es stellt sich heraus, daß die Bakterien an der Oberfläche den Sauerstoff, während die Bakterien im Boden das Sediment verbrauchen, wobei ein Nanodraht-Netzwerk bestimmte Bakterien miteinander verbindet, damit dies alles funktioniert. Um diese Energie nutzen, könnte ein großes Netzwerk aus Graphitelektroden in den Meeresboden eingebettet werden, um die kleinen Ströme zu sammeln, die aus den Bakterien emittieren. Wie viel Energie sich mit dieser Methode tatsächlich erzeugen ließe, ist allerdings noch nicht bekannt. Es hat sich bislang auch nichts über eine Fortführung dieser Untersuchungen finden lassen.
Im April 2010 meldet die Presse, daß es Wissenschaftlern
der Stanford University in Kalifornien in Zusammenarbeit
mit Won Hyoung Ryu von der Yonsei University in
Seoul, Südkorea, gelungen sei, Energie aus den photosynthetischen Prozessen
in der einzelligen Grünalge Chlamydomonas zu
sammeln, indem sie direkt auf die Elektronen-Ströme zugreifen, die auf
der zellulären Ebene erzeugt werden.
Die Photosynthese findet in den Chloroplasten der Pflanzenzellen statt, wo das Sonnenlicht in chemische Energie umgewandelt wird. Dabei werden energiereiche Elektronen frei – und als Nebenprodukte entstehen nur Protonen und Sauerstoff. Die Forscher entziehen der Alge nun die gesammelte Sonnenenergie, bevor die Pflanze sie nutzen kann, indem sie eine winzige Goldelektrode in die Chloroplasten einer Algenzelle einsetzen und diese mit einem Meßgerät verbinden. Um den Kreislauf zu schließen, wird eine weitere Goldelektrode in das Wachstumsmedium eingebracht.
Werden die Algen mit einer Halogenlampe beleuchtet, fangen die Goldelektroden bis zu 20 % der dabei frei werdenden Elektronen ab. Je nach Lichtintensität werden Energiewerte von 0,6 - 6,0 mA/cm2 gemessen. Bevor das Verfahren jedoch kommerziell nutzbar gemacht werden kann, gilt es insbesondere die Frage zu klärten, welchen Einfluß der Verlust der Elektronen auf die Lebenszeit der Zellen hat.
Auf jeden Fall ist das Ernten von Elektronen auf diese Weise wesentlich effizienter, als Biokraftstoffe zu verbrennen, da die meisten hierfür verarbeiteten Pflanzen nur etwa 3 - 6 % der verfügbaren Sonnenenergie speichern. Ryus Verfahren erreicht hingegen bereits jetzt schon eine Effizienz von etwa 20 % und könnte – zumindest theoretisch – eines Tages sogar bei nahezu 100 % landen. Die nächsten Schritte sind die Nutzung einer Pflanze mit größeren Chloroplasten für einen größeren Sammelbereich, sowie eine größere Elektrode, die mehr Elektronen erfassen kann.
(Grafik)
Ebenfalls mit der Energiebeschaffung aus Algen beschäftigen
sich ab 2010 die Professoren Chris Howe und Alison
Smith von der University of Cambridge, die
gemeinsam mit ihren Kollegeginnen Prof. Laurie Peter und Petra
Cameron von der University of Bath an der
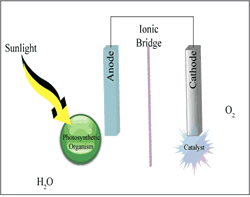
Entwicklung einer biophotovoltaischen Zelle (biophotovoltaics,
BPV) auf Basis von Algen und photosynthetischen Bakterien arbeiten.
Hierzu bedienen sie sich der Abscheidung eines Films aus Photosynthesezellen
auf einer transparenten leitfähigen Elektrode, die einer mit Platin-Nanopartikeln
angereicherten Kohlenstoffkathode gegenübersteht.
Bei Sonneneinstrahlung beginnen die Algenzellen mit der Spaltung von Wasser und der Produktion von Sauerstoff, Elektronen und Protonen, wobei die Algenzellen sehr großzügig Elektronen erzeugen. In der Regel würden diese von den Algen verwendet werden, um Kohlendioxid in organische Verbindungen umwandeln. Statt dessen saugt das Gerät die Elektronen ab, um Strom zu generieren.
Das Team verwendet als konzeptionellen Beweis ein Gerät, das eine Uhr mit Strom versorgt. Die Effizienz der Wandlung von Sonnenlicht in Elektrizität beträgt zwar nur 0,1 %, soll aber durch die Untersuchung verschiedener Algenarten gesteigert werden, indem die produktivsten Elektronen abgebenden Typen gefunden werden. Wirtschaftlich könnte die Angelegenheit trotzdem werden, denn Algenzellen können auf der See schwimmen und Strom aus Sonnenlicht und Meerwasser erzeugen, ohne dazu teure Landflächen zu benötigen.
(Grafik)
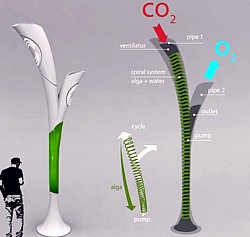
Wie man sich ein praktisches Gerät vorstellen könnte, das Algen zur
Energieerzeugung nutzt, zeigt der ungarische Industriedesigner Peter
Horvath.
Das Konzept seiner Biolamp, das bereits im Januar 2011 in den Blogs erscheint, ist eine umweltfreundliche Straßenlaterne, die mit im Wasser schwimmenden Algen gefüllt ist und eine Pumpe zum Ansaugen des städtischen Smog besitzt. Aus diesem wird das CO2 in O2 umgewandelt, worauf der Sauerstoff wieder in die Atmosphäre abgegeben wird.
Wenn die Lampe mehr Biomasse entwickelt, als sie selbst braucht, verwendet sie ein unterirdisches Rohrsystem, um den Überschuß zur nächsten Füllstation zu fördern, wo er in einem Biokraftstoff umgewandelt werden kann. Das komplizierte System ist vermutlich nicht umsetzbar, könnte aber gut als Anregung zur Entwicklung einiger Innovationen dienen.
Christopher Hurley, ein auf Energiespeicher-Systeme
spezialisierter Ingenieur der U.S. Army (CERDEC),
gibt im August 2010 bekannt, daß das Verteidigungsministerium
im Folgejahr Feldversuche mit selbstentwickelten enzymatischen
Brennstoffzellen
durchführen wird, die billig und ungiftig sind und mit der nicht brennbaren
Kraftstoffquelle Zucker betrieben werden, welche bereits Teil der Lieferkette
der Army ist. Die erste Zielanwendung ist es, eine saubere, erneuerbare
Energiequelle für die Soldaten zur Verfügung zu stellen, um deren Last
an Batterien zu verringern.
Auf der Power Sources Conference demonstriert Hurley eine Bio-Batterie, die mit einer elektronischen Vorrichtung verbunden ist, welche einen Mikroprozessor und eine LCD-Anzeige umfaßt und diese unter Verwendung von weniger als 20 ml Zuckerlösung für mehr als 10 Stunden versorgen kann. Allerdings läßt sich später nichts mehr über eine Weiterentwicklung dieser Zelle finden.
Wissenschaftler der University of Wisconsin-Milwaukee (UWM)
um Prof. Junhong Chen berichten im Juli 2012,
daß sie einen kostengünstigen Nanostäbchen-Katalysator identifiziert
haben, dessen Effizienz der von Platin gleicht. Die mit Stickstoff
angereicherten Eisen-Kohlenstoff-Nanostäbchen könnten zu billigen und
wirkungsvollen MFCs führen, die ihre eigenen Wasserstoff aus Abwasser
erzeugen.
Bisher besteht der Katalysator in der Regel aus Platin, das zwar gute Arbeit leistet, mit über 1.200 $ pro Unze (28,35 g) dafür aber auch extrem teuer ist. Außerdem ist Platin, wie viele andere Katalysatoren, anfällig für eine ,Vergiftung’ durch Verunreinigungen, welche die Oberfläche bedecken und teuren Ersatz erfordern.
Im Gegensatz dazu wird der Nanostäbchen-Katalysator der UWM von billigen, gängigen Elementen zusammengesetzt: Er besteht aus Stickstoff, der mit der Oberfläche eines Kohlenstoffstabes verbunden ist, welchen einen Kern aus Eisencarbid besitzt, eine Struktur, die sich optimal für den Elektronentransport eignet.
Auch nach mehr als drei Monaten des Testlaufs zeigt der neue Katalysator eine konstante Leistung, die dem des Platins sogar überlegen ist und alle Indikatoren eines stabilen und skalierbaren Systems zeigt. Und da Platin 60 % der Kosten einer MFC ausmacht, sind die Einsparungen betröchtlich, die der neue UMW-Katalysator verspricht, der mit nur 5 % der Kosten eines Platinkatalysators zu Buche schlägt. Weshalb sich Chen und sein Team nun darauf konzentrieren, die genauen Eigenschaften des Katalysator zu studieren und ihn für die Massenproduktion geeignet zu machen.
Im Mai 2013 berichten
die Fachblogs über eine Entdeckung an der University of Georgia (UGA),
wo es einem Forschertem um Prof. Ramaraja Ramasamy gelungen
ist, die Photosynthese direkt zur
Stromerzeugung zu nutzen. Immerhin sind Pflanzen die unangefochtenen
Meister der Sonnenenergie, die nach Milliarden Jahren der Evolution
in den meisten Fällen eine Quanteneffizienz von fast 100 % erreichen,
was bedeutet, daß eine Pflanze für jedes Photon des eingefangenen Sonnenlichts
die gleiche Anzahl von Elektronen erzeugt.

an der UGA
Die Wissenschaftler entwickeln einen Weg, um die Photosynthese zu unterbrechen, wodurch sie die Elektronen einfangen können, bevor die Pflanze diese nutzt, um Zucker zu machen. Die Technologie beinhaltet, aus den Pflanzenzellen Strukturen herauzustrennen, die Thylakoide genannt werden und für die Erfassung und Speicherung der Energie aus dem Sonnenlicht verantwortlich sind. Anschließend manipulieren sie die in den Thylakoiden enthaltenen Proteine, um den Weg zu unterbrechen, entlang dem die Elektronen fließen.
Diese modifizierten Thylakoide werden dann auf einer speziell konstruierten Unterlage aus Kohlenstoff-Nanoröhren immobilisiert. Die Nanoröhrchen, zylindrische Strukturen, die fast 50.000 mal feiner sind als ein menschliches Haar, wirken als elektrischer Leiter, welche die Elektronen aus dem Pflanzenmaterial erfassen und in einem Draht weiterleiten.
Bereits im Laborexperiment wird mit dem neuen Ansatz ein elektrischer Strom erzielt, der um zwei Größenordnungen höher ist als alles, was zuvor über ähnliche Systemen berichtet wurde. Bis diese Technologie das Niveau der Kommerzialisierung erreicht, muß Ramasamy zufolge aber noch viel getan werden. Zu allererst geht es darum, die Stabilität und Leistung des Geräts zu verbessern.

Über eine besonders interessante Untersuchung wird im Juli 2013 berichtet,
als Sabine Sané, Doktorandin am Institut für Mikrosystemtechnik
(IMTEK) der Universität Freiburg, auf der Basis ihrer
Doktorarbeit ein Konzept entwickelt, einen Baumpilz für
die Erzeugung von Strom einzusetzen – und dabei gleichzeitig Mikroschadstoffe
im Abwasser abzubauen. Hierzu gehören u.a. Schwermetalle, synthetische
organische Stoffe, Viren und Bakterien. Liegt deren Konzentration im
Mikrogrammbereich pro Liter, spricht man von Mikroschadstoffen. Hinzu
kommen Substanzen, die durch Kläranlagen nicht abgebaut werden, wie
etwa Arzneimittelrückstände, Kontrastmittel oder Antibiotika aus der
Massentierhaltung.
Abhilfe schaffen könnte Sané zufolge der Baum-Weißfäulepilz Trametes versicolor (Schmetterlingstramete), der in Mitteleuropa vorwiegend auf Rotbuchen wächst und das Enzym Laccase absondert, mit dem die Mikroschadstoffe oxidiert und damit in ihre Bestandteile zerlegt werden können. Als wirtschaftlich günstige Methode wird das ganze Pilzgemisch eingesetzt, wobei sich zeigt, daß der Pilz wie Schimmel auf dem Apfelsaft auch auf einer flüssigen Kultur wächst, wenn er nur seine Nährstoffe bekommt.
Zudem stellt Sané fest, daß sich mit dem gleichen Baumpilz auch die Leistung einer hybriden mikrobiell-enzymatischen Brennstoffzelle verbessern läßt. Für ihr Konzept erhält sie im Jahr 2014 einen Preis der Huber Technology Stiftung zum Thema ,Ressourcen und Energie aus Wasser’.
Neben den o.e. Arbeiten von Igor Aronson gibt es noch mehrere andere mehrere Gruppen, die versuchen, lebende Organismen in mikromechanische Bauelemente zu integrieren und ihre Bewegungen zum Antreiben winziger Motoren für Mikroroboter oder Mikrotransportsysteme zu nutzen.
So berichtet Howard C. Berg von der Harvard University schon im Juli 2003 über die Fortbewegungsmethode begeißelter Bakterien wie Escherichia coli mittels rotierender dünner helikaler Filamente (s.u.), die jeweils an ihrer Basis durch einen reversiblen Drehmotor angetrieben werden, welcher wiederum durch einen Ionenfluß mit Energie versorgt wird.
Der einzelne Motor hat einen Durchmesser von etwa 45 nm und ist aus etwa 20 verschiedenen Teilen zusammengesetzt. Er entwickelt sein maximales Drehmoment im Stillstand, kann sich aber auch mit mehreren hundert Hz drehen. Die Drehrichtung wird dabei durch eine Sensorik gesteuert, die es den Zellen ermöglicht, sich in Regionen anzusammeln, die als günstiger erachtet werden als andere.
Berg meint, daß man inzwischen zwar schon eine ganze Menge über Motorstruktur, Genetik, Zusammenstellung und Funktion weiß – aber noch nicht wirklich verstehen würde, wie das Ganze tatsächlich funktioniert.
Trotzdem kann der Wissenschaftler gemeinsam mit N. Darnton et al. von der Brown University in Providence, Rhode Island, schon 2004 zeigen, wie eine bakterielle Fest/Flüssig-Schnittstelle zu konstruieren ist, aus der sich Pumpen oder Mischer für mikrofluidische Systeme bauen lassen. Dabei werden Kolonien des Bakteriums Serratia marcescens auf einer festen Oberfläche aus Polydimethylsiloxan (= Silikonkautschuk; Silikonharz) oder Polystyrol (Polystyren) angesiedelt, so daß die Zellkörper eine dicht gepackte Monoschicht bilden (Bakterienteppich), während sich ihre Flagellen (o. Geißeln) weiterhin frei drehen können.
Bei den Flagellen handelt es sich um nicht aktiv verformbare fadenförmige Proteinstrukturen auf der Oberfläche einzelner Zellen, die durch Rotation peitschenartig bewegt werden und hauptsächlich der Fortbewegung dienen, aber auch Nahrungspartikel herbei strudeln oder die Zelle am Substrat verankern können. Einzeller mit Geißeln werden Flagellaten (o. Geißeltierchen, Geißelalgen) genannt und verfügen über eine einzige Flagelle – bis hin zu Tausenden davon.
Die mit Tracer-Perlen sichtbar gemachte Bewegung der Flüssigkeit nahe einer bakteriell belebten ebenen Fläche erweist sich als sehr viel stärker, als die weiter entfernte Bewegung. Zudem zeigen die Tracer-Perlen komplexe, sich ständig ändernde Strömungsmuster, einige davon linear (Flüsse), andere rotativ (Whirlpools), die aber auch für mehrere Minuten einigermaßen stabil bleiben können. Durch eine verbesserte Koordinierung hofft man nun, größere und längerfristige Effekte produzieren zu können.

Im Vorgriff auf die Chronologie: Zu dem Thema Flagellen erscheint im März 2016 ein Bericht von Forschern des Imperial College London um Morgan Beeby und weiteren Kollegen aus verschiedenen US-Universitäten, denen es mittels einer Technik namens 3D-Kryoelektronentomographie erstmals gelungen ist, hochauflösende Bilder von den biologischen Motoren und ihrer Funktion zu machen.
Die Abbildungen zeigen, daß verschiedene Bakterien auch ziemlich verschiedene und auch unterschiedlich große Motoren haben, obwohl sie alle eine Reihe fester Ringe an ihrer Basis besitzen – dem Äquivalent eines Stators. Dieser feste Abschnitt ermöglicht es ihnen, einen Drehmoment zu erzeugen, der es dem propellerartigen Schwanz wiederum erlaubt, das Bakterium nach vorne zu treiben.
Anderen – und etwas ausführlicheren – Quellen zufolge veröffentlicht das California Institute of Technology (Caltech) im März 2016 gleich zwei Studien, in denen die superkleinen biologischen Motoren, die die Bakterien antreiben, als farbenfrohe 3D-Darstellungen zu sehen sind. Um die Mikromotoren abzubilden, setzt das Team um Prof. Grant Jensen die Elektronen-Kryotomographie ein, bei der die Bakterienzellen so schnell eingefroren werden, daß die in ihnen enthaltenen Wassermoleküle keine Zeit haben, sich zu Eiskristallen anzuordnen.

(Montage)
Sobald die Zellen auf diese Weise in ihrer ursprünglichen Struktur gefangen sind, wird ein Elektronenmikroskop verwendet, um eine Reihe von 2D-Bildern aufzunehmen, die dann so zusammengesetzt wurden, daß digitale 3D-Bilder entstehen. In Zusammenarbeit mit Kollegen in den USA, dem Vereinigten Königreich und Deutschland bildet das Team zwei verschiedene Arten bakterieller Motoren ab.
Der in der ersten Studie behandelte Motor stammt von einem räuberischen Bodenbakterium namens Myxococcus xanthus und wird als Typ-IVa-Pilusmaschine (T4PM) bezeichnet. Mit diesem Mechanismus können sich Bakterien fortbewegen, indem sie eine lange Faser, den Pilus, aussenden. Diese Faser heftet sich an eine Oberfläche, und dann rollt sich das Bakterium entlang des Fadens vorwärts. Dabei handelt es sich möglicherweise um den stärksten in der Natur bekannten Motor (‚Architecture of the type IVa pilus machine‘).
Bei dem zweiten biologischen Motor handelt es sich um einen, der das Flagellum antreibt – einen winzigen peitschenartigen Propeller, den man bei verschiedenen Bakterien beobachten kann. Dabei entdecken die Caltech-Forscher, daß es im Inneren der Bakterien Motoren aus Proteinen gibt, die das Flagellum mit einem erheblichen Drehmoment rotieren lassen (‚Diverse high-torque bacterial flagellar motors assemble wider stator rings using a conserved protein scaffold‘, vollständig einsehbar).
In einer Veröffentlichung vom Juli 2005 präsentieren Douglas
B. Weibel et al. an der Harvard University den
Prototyp eines Mikrotransportsystems, bei dem Einzeller der Alge Chlamydomonas
reinhardtii als Mikro-Transporter oder ,Mikro-Ochsen’ dienen,
um an ihnen befestigte Mikroobjekte mittels ihrer Geißeln durch einen
Kanal aus Polydimethylsiloxan in Richtung einer Lichtquelle zu bewegen.
Dabei wird die Oberflächenchemie verwendet, um an den Zellen Lasten
in Form von 1 - 6 µm durchmessenden Polystyrolkügelchen zu befestigen,
sogenannte Phototaxis, um die schwimmenden Zellen zu steuern, und die
Photochemie, um die Lasten wieder zu lösen.
Die beweglichen Mikroorganismen können Mikro-Lasten von 3 µm Durchmesser mit Geschwindigkeiten von etwa 100 - 200 µm/s über Entfernungen bis rund 20 cm transportieren. Die Forschung wird durch Zuschüsse aus dem Department of Energy und dem National Institutes of Health (NIH) unterstützt.
Der Aspekt der Biogefährdung durch gentechnisch veränderte Mikroorganismen,
wenn sie außerhalb des Labors verwendet werden, wird im Rahmen eines
Berichts vom Oktober 2005 thematisiert, in welchem Atsuko
Uenoyama und Makoto Miyata von der Osaka
City University über die erfolgreiche Herstellung gleitender
,Geister’ der Spezies Mycoplasma mobile berichten, die ihren
Namen deshalb tragen, weil sie sich von allen Mycoplasma-Spezies,
die als die kleinsten lebenden Einheiten überhaupt betrachtet werden,
am schnellsten fortbewegen.
Das Herstellen der Geister gelingt durch die teilweise Auflösung der Zellmembran unter Verwendung von Triton X-100, einem nichtionischen Tensid aus der Gruppe der Octylphenolethoxylate, das wissenschaftlich als Octoxinol 9 bekannt ist. Triton X-100 und Nonidet P40 sind die Markennamen dieser Substanz.
Diese Geister sind zwar nicht (mehr) lebendig, ihre Motoreinheiten aber noch aktiv, so daß sie mit einer ähnlichen Geschwindigkeit gleiten wie die intakten Zellen, wenn exogen Adenosintriphosphat (ATP) zugeführt wird. Dabei werden rund 85 % der Geister reaktiviert. Die japanischen Forscher betrachten solche Geister als vormontierte supramolekulare Motoreinheiten mit hervorragender Leistung, mit denen zudem das Problem einer potentiellen Biogefährdung umgangen wird. Die Reaktivierungsaktivität und die Hemmung durch verschiedenen Nukleotide und ATP-Analoga, sowie deren kinetische Parameter zeigen, daß die Maschine durch die Hydrolyse von ATP zu ADP und Phosphat angetrieben wird, die durch eine bislang unbekannte ATPase verursacht wird.
(Grafik)
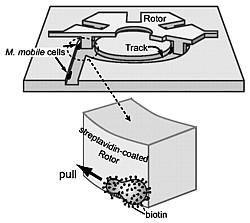
Im September 2006 berichten Forscher um Prof. Yuichi
Hiratsuka am Japan Advanced Institute of Science and
Technology (JAIST) über ihre Forschungen an dem Einzeller Mycoplasma
mobile. Der Mikroorganismus hat einen birnenförmigen Zellkörper,
ist etwa 1 µm lang und bewegt sich über Festkörperoberflächen kontinuierlich
mit Geschwindigkeiten von bis zu 5,2 µm pro Sekunde.
Um einen aus Siliziumdioxid konstruierten, 20 µm großen Rotor auf einer Siliziumbahn in Drehung zu versetzen, wird ausgenutzt, daß die Bakterien dazu neigen, entlang lithographischer Mikrostrukturen – wie entlang dem Fußende winziger Wände – zu gleiten. Dies macht es möglich, Muster zu entwerfen, welche die Richtung ihrer Bewegung steuern.

Das zu drehende Rädchen des Mikromotors sitzt dabei mit kleinen Füßchen in dem darunter angelegten, kreisförmigen Siliziumkanal, und die sich darin vorwärts bewegenden Bakterien schieben die Füßchen vor sich her. Damit die Einzeller ,zusammenarbeiten’, wird in den Kanälen ein spezielles Eiweiß integriert, auf das die Bakterien angewiesen sind. So gelingt es, daß sich 65,7 % aller Mycoplasma-Zellen in dieselbe Richtung bewegen und den Rotor dadurch in Drehung versetzen.
Bei einem mutierten Strang desselben Lebewesens und mit einer speziellen Beschichtung der Konstruktion lassen sich sogar 84 % der mit Glukose gefütterten Arbeiter in die korrekte Richtung weisen. In seltenen Fällen ändert ein sich kontinuierlich drehender Rotor aber auch abrupt die Richtung.
Obwohl der Rotor eine Drehzahl von 1,5 - 2,6 U/m erreicht, was einer linearen Geschwindigkeit von 1,2 – 2,1 μm pro Sekunde entspricht (oder rund 7 mm pro Stunde), kommt der winzige Motor lange nicht an die Leistungsfähigkeit mikroelektromechanischer Systeme (MEMS) heran, und sein Drehmoment ist um etwa vier Größenordnungen kleiner als der von elektrostatischen Mikroaktuatoren. Dem gegenüber steht, daß sich das Antriebsmittel des Mikrobenmotors erneuert und Verschleißerscheinungen selbst repariert werden.
Weiter mit den Bakteriellen Systemen...